相同物质的量浓度的NaCN和NaClO溶液相比,NaCN溶液的pH较大,则关于同温同体积同浓度的HCN和HClO的说法中正确的是
| A.电离程度:HCN>HClO |
| B.pH:HClO>HCN |
| C.与NaOH溶液恰好完全反应时,消耗NaOH的物质的量:HClO>HCN |
| D.酸根离子浓度:c(CN-)<c(ClO-) |
下列实验操作中,正确的是()
| A.蒸发结晶时,应将溶液蒸干后才停止加热 |
| B.蒸馏中,应使温度计水银球靠近蒸馏烧瓶支管口处 |
| C.分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出 |
| D.配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释至刻度线 |
反应aA(g)+bB(g)⇌cC(g)△H,生成物C的质量分数与压强P和温度T的关系如图, 方式中的系数和△H的大小符合图象的是()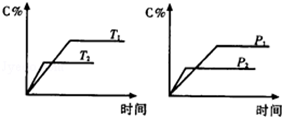
| A.a+b=c △H>0 | B.a+b>c △H<0 |
| C.a+b<c △H>0 | D.a+b<c △H<0 |
在密闭容器中反应:aX(g)+bY(g)⇌cZ(g)+dW(g),反应达到平衡后,保持温度不变,将气体压缩到原来的一半体积,当再次达到平衡时,W的浓度为原平衡的1.8倍.下列叙述不正确的是()
| A.平衡向逆反应方向移动 | B.a+b>c+d |
| C.Z的体积分数减小 | D.X的转化率下降 |
在2A+B⇌3C+4D反应中,表示该反应速率最快的是()
①单位时间内生成a mo1 O2的同时生成2a mol NO2
②单位时间内生成a mol O2的同时生成2a molNO
③混合气体的颜色不再改变
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
| A.①③④ | B.②④⑤ | C.①③⑤ | D.①②③④⑤ |
用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是()
A.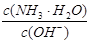 |
B.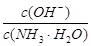 |
| C.c(H+)和c(OH-)的乘积 | D.OH-的物质的量 |