用铂惰性电极进行电解,下列说法正确的是
| A.电解饱和的食盐水,阳极产物是氢氧化钠和氯气 |
| B.电解饱和的氯化钠溶液,在阴极析出钠 |
| C.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为2:1 |
| D.电解熔融的氯化钠,在阴极上和阳极上析出产物的物质的量之比为2:1 |
下列离子或物质组能大量共存,进行相关操作后出现的现象或结论叙述完全正确的一组是
| 选项 |
离子或物质 |
操作、现象或结论 |
| A |
Na+、 K+、Cl—、SO42— |
通入 CO2后 c(Na+)+c(K+)=c(SO42-)+ c(Cl—) +c(CO32-)成立 |
| B |
NH4+、Mg2+、Cl—、NO3— |
加入铝粉能产生氢气 |
| C |
K+、Cr2O72—、CH3CH2OH、SO42— |
加入盐酸后溶液褪色 |
| D |
SO2、O2、NO2 |
混合气体通入足量NaOH溶液后,可能会没有任何气体剩余 |
用NA表示阿伏伽徳罗常数的值,下列说法正确的是()
| A.常温常压下,26g乙炔含有的∏键数目为3NA |
| B.7.8gNa2O2中所含阴离子的数目是0.2NA |
| C.标准状况下,2.24Ll8O2中所含中子的数目是2NA |
| D.在密闭容器中盛有0.lmolN2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6 NA |
化学与科学、技术、社会、环境密切相关。下列有关说法中正确的是()
| A.煤经过气化和液化两个物理变化,可变为清洁能源 |
| B.天宫一号使用的碳纤维是一种新型的有机高分子材料 |
| C.发酵粉中主要含有氢氧化钠,能使焙制出的糕点疏松多孔 |
| D.石油催化裂化的主要目的是提高汽油等轻质油的产量与质量,石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃 |
地球上99%的溴元素存在于海洋中,资料显示海水中溴含量约为66mg·L—1。从海水中提取溴的工业流程如下: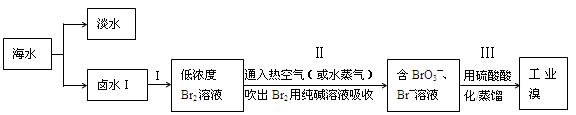
(1)写出海水淡化的一种方法:。
(2)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用到溴的性质是。
(3)以上步骤I中已获得游离态的溴,步骤Ⅱ又将之转化成化合态的溴,其目的是
。
(4)上述流程中吹出的溴蒸气,也可以用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的化学方程式:。
(5)实验室从溴水中分离溴还可以用萃取法,下列可以用作溴的萃取剂的是
a.乙酸 b.四氯化碳 c.裂化汽油 d.苯
(6)假设提取过程中溴没有损失,计算1m3海水按上述流程进行实验时,步骤中Ⅱ约需消耗lmol·L—1Na2CO3溶液L。
已知:2SO2(g)+O2(g) 2SO3(g)△H=—196.6kJ·mol—1,向密闭容器中加入2mol SO2(g)和1mol O2,一定条件下反应达到平衡,在t2和t4时刻分别只改变一个条件(温度或压强),反应过程中正反应速率如下图所示,下列说法正确的是
2SO3(g)△H=—196.6kJ·mol—1,向密闭容器中加入2mol SO2(g)和1mol O2,一定条件下反应达到平衡,在t2和t4时刻分别只改变一个条件(温度或压强),反应过程中正反应速率如下图所示,下列说法正确的是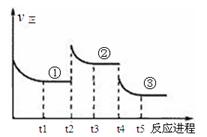
注:t1~t2、t3~t4、t5之后各时间段表示达到平衡状态①、②、③。
| A.t2~t3时间段,平衡向逆反应方向移动 |
| B.平衡状态①和②,平衡常数K值相同 |
| C.平衡状态①和②,SO2转化率相同 |
| D.t4时刻改变的条件是减小压强 |