利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程如下:

已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的作用有 。
| A.去除油污 | B.溶解镀锌层 | C.去除铁锈 | D.钝化 |
(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是 。
(3)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,其原因是 。
(4)Fe3O4胶体粒子能否用减压过滤法实现固液分离 (填“能”或“不能”),理由是 。
(5)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.01000mol·L-1的K2Cr2O7标准溶液250mL,应准确称取K2Cr2O7 g(保留4位有效数字,已知M(K2Cr2O7)=294.0g·mol-1)。配制该标准溶液时,下列仪器不必要用到的有 。(用编号表示)
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
(6)滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则滴定结果将 (填“偏大”、“偏小”或“不变”)。
资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。某同学设计了如下实验方案并验证产物、探究反应原理。
(1)提出假设
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为。
猜测2:白色不溶物可能为MgCO3。
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3·yMg(OH)2]。
(2)设计定性实验确定产物并验证猜测:
| 实验序号 |
实验 |
实验现象 |
结论 |
| 实验Ⅱ |
将实验I中收集到的气体点燃 |
能安静燃烧、产生淡蓝色火焰 |
气体成分为 __ |
| 实验Ⅲ |
取实验I中的白色不溶物,洗涤, 加入足量 |
|
白色不溶物可能含有MgCO3 |
| 实验Ⅳ |
取实验I中的澄清液,向其中加入少量CaCl2稀溶液 |
产生白色沉淀 |
溶液中存在 ④离子 |
(3)为进一步确定实验I的产物,设计定量实验方案,如图所示: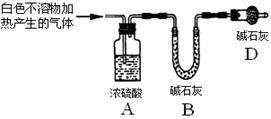
称取实验Ⅰ中所得干燥、纯净的白色不溶物22.6 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验前后装置A增重1.8 g,装置B增重8.8 g,试确定白色不溶物的化学式。
(4)用必要的语言文字叙述并结合方程式说明为什么碳酸氢钠溶液能和镁反应生成氢气?
过氧化钠(Na2O2)是中学常见物质,常见的过氧化物还包括过氧化钙(CaO2)。已知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成。有人提出CO2、SO2与过氧化钠的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断。
实验一:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。
(1)提出假设:
假设1:反应后固体中只有Na2SO3,证明SO2未被氧化;
假设2:反应后固体中只有Na2SO4,证明SO2完全被氧化;
假设3:__________________________证明______________________。
实验探究:
实验二:通过测量气体的体积判断发生的化学反应,实验装置如下: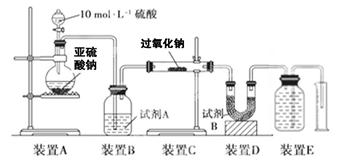
(2)试剂A可以选用________,试剂B的作用是________。
(3)实验测得装置C中过氧化钠质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),用上述有关测量数据判断,SO2未被氧化、完全被氧化的V-m1关系式。
未被氧化:____________,完全被氧化:____________。
(4)若SO2完全被氧化,写出反应的化学方程式: __________________________。
(1)设计一个简单的一次性完成实验的装置,验证醋酸、二氧化碳水溶液(碳酸)和苯酚的酸性,其强弱的顺序是:CH3COOH> H2CO3> C6H5OH
①利用下列仪器可以组装实验装置,则仪器的连接顺序是:。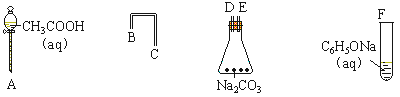
②写出实验过程中发生反应的实验现象、。
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为。
Ⅰ.下列实验操作中正确的是
| A.分液时,分液漏斗下层液体从下端放出,上层液体从上口倒出 |
| B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C.蒸发结晶时应将溶液直接蒸干 |
| D.称量非腐蚀性药品应放在托盘天平左盘的称量纸上,砝码放在托盘天平右盘的称量纸上 |
Ⅱ.影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究。他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素。甲同学的实验报告如下表:
| 实验步骤 |
现象 |
结论 |
| ①分别取等体积2mol/L的硫酸于试管中 ② |
Mg产生气泡速率快于Fe,Cu无明显变化 |
金属性质越活泼,反应速率越快 |
(1)甲同学表中实验步骤②为。
(2)甲同学的实验目的是探究。
乙同学为了更精确地研究浓度对反应速率的影响,利用下图所示装置进行定量实验。
(3)乙同学在实验中应该测定的数据是。
(4)乙同学完成实验应选用的实验药品是。
下图中的实验装置可以用于实验室制取乙炔。请填空: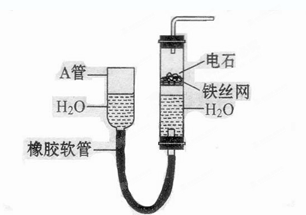
(1) 图中A管的作用是,
制取乙炔的化学反应方程式为。
(2)乙炔通入酸性KMnO4溶液中,发生反应,可以观察到
现象,若通入溴水中,发生反应。
(3)乙炔燃烧的化学方程式为,燃烧时的现象为,
为了安全,点燃乙炔前应该先。