为提纯下列物质(括号内为杂质),选用的试剂或方法有错误的是
| |
物质 |
试剂 |
分离方法 |
| A |
硝酸钾(氯化钠 ) |
蒸馏水 |
降温结晶 |
| B |
氢氧化铁胶体(Fe3+) |
蒸馏水 |
渗析 |
| C |
甲烷(乙烯) |
酸性高锰酸钾溶液 |
洗气 |
| D |
乙醇(水) |
生石灰 |
蒸馏 |
下图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是()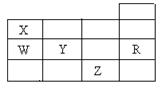
| A.工业上合成X的氢化物采用高温高压催化剂条件 |
| B.Z2水溶液中通入YO2后褪色,表现了YO2的漂白性 |
| C.常压下五种元素的单质中,Z单质的熔点最高 |
| D.Y、Z的阴离子电子层结构都与R原子的相同 |
下图是一些常见有机物的转化关系,关于反应①~⑦的说法不正确的是()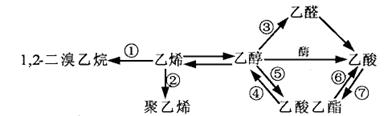
| A.反应①是加成反应 | B.只有反应⑦是取代反应 |
| C.反应④⑤⑥⑦是取代反应 | D.只有反应②是加聚反应 |
现有如下各说法
①在水中氢、氧原子间均以化学键相结合
②金属元素和非金属元素形成的化学键为离子键。
③离子键是阳离子、阴离子的相互吸引。
④根据电离方程式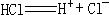 ,可判断HCl分子里存在离子键。
,可判断HCl分子里存在离子键。
⑤互为同素异形体的物质性质完全不同。
⑥分子组成相差一个或若干个“CH2”原子团的有机化合物互称为同系物
上述各种说法中正确的有几句()
| A.0 | B.1句 | C.2句 | D.3句 |
青苹果汁遇碘溶液显蓝色,熟苹果能还原银氨溶液。这说明()
| A.青苹果中只含淀粉不含糖类 | B.熟苹果中只含糖类不含淀粉 |
| C.苹果成熟时淀粉水解为葡萄糖 | D.苹果成熟时单糖聚合成淀粉 |
元素R有如下反应:RO3—+5R-+6H+===3R2+3H2O,下列说法正确的是()
| A.元素R位于周期表中第ⅤA族 |
| B.RO3—中的R只能被还原 |
| C.每反应消耗1 mol RO3—,转移电子的物质的量为5 mol |
| D.R2在常温常压下一定是气体 |