下列说法正确的是
A.已知:H2(g)+ O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1, O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1,则H2的燃烧热为-285.8 kJ·mol-1 |
| B.已知:S(g)+O2(g)=SO2(g) ΔH1=-Q1; S(s)+O2(g)=SO2(g) ΔH2=-Q2,则Q1<Q2 |
C.已知: H2SO4(浓)+NaOH(aq)= H2SO4(浓)+NaOH(aq)= Na2SO4(aq)+H2O(l) ΔH1; Na2SO4(aq)+H2O(l) ΔH1;CH3COOH(aq)+NH3·H2O(aq)=CH3COONH4(aq)+H2O(l) ΔH2,则有|ΔH1|<|ΔH2| |
| D.已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH=+489.0 kJ·mol-1 |
CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
C(石墨)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
则4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1 641.0 kJ·mol-1
X、Y、Z、w是分别位于第2、3周期的元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、w原子的最外层电子数之和为14。下列说法正确的是
| A.原子半径由小到大的顺序:X< Y < Z< w |
| B.Z的最高价氧化物能与水反应生成相应的酸 |
| C.Y单质在一定条件下可以与氧化铁发生置换反应 |
| D.室温下,0.1 mol/L w的气态氢化物的水溶液的氢离子浓度小于0.1 mol/L |
砷为第四周期第ⅤA族元素,依据它在周期表中的位置,推测砷不可能具有的性质是
| A.砷在通常状况下为固体 |
| B.砷的最高正化合价为+5 |
| C.砷的最高价氧化物的水化物砷(H3AsO4)的酸性比磷酸(H3PO4)强 |
| D.砷化氢(AsH3)不如氨气(NH3)稳定 |
下列各组中的性质比较,不正确的是
| A.稳定性:NH3<PH3<SiH4 |
| B.酸性:HClO4>H2SO4>H3PO4 |
| C.碱性:KOH>NaOH>Mg(OH)2 |
| D.还原性:F﹣<Cl﹣<Br﹣ |
元素R的最高价含氧酸的化学式为HnRO2n-2,则在气态氢化物中R元素的化合价为
| A.12-3n | B.3n-12 | C.3n-10 | D.6-3n |
Se是人体必需微量元素,下列关于 和
和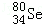 的说法正确的是
的说法正确的是
A. 和 和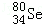 互为同素异形体 互为同素异形体 |
B. 和 和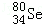 互为同位素 互为同位素 |
C. 和 和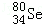 分别含有44和46个质子 分别含有44和46个质子 |
D. 和 和 都含有34个质子和中子 都含有34个质子和中子 |