某航空站安装了一台燃料电池,该电池可同时提供电和水蒸气。所用燃料为氢气,电解质为熔融的碳酸钾。已知该电池的总反应为2H2+O2=2H2O,正极反应为O2+2CO2+4e-=2CO32-,则下列推断正确的是
| A.负极反应为H2+2OH--2e-=2H2O |
| B.该电池可在常温或高温时进行工作,对环境具有较强的适应性 |
| C.该电池供应2 mol水蒸气,同时转移2 mol电子 |
| D.放电时负极有CO2生成 |
有一电解池中X,Y分别是直流电源的两极,通电后发现a极(连X)板质量增加,b极(连Y)板处有无色无臭气体放出,符合这一情况的是附表中的
附表可供选择的极板、电极和溶液组
| 组合 |
a极板 |
b极板 |
X电极 |
Z溶液 |
| A |
锌 |
石墨 |
负极 |
CuSO4 |
| B |
石墨 |
石墨 |
负极 |
NaOH |
| C |
银 |
铁 |
正极 |
AgNO3 |
| D |
铜 |
石墨 |
负极 |
CuCl2 |
铁和足量的稀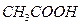 反应时,加入少量
反应时,加入少量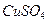 固体,下列叙述正确的是
固体,下列叙述正确的是
A.反应速率减慢,产生 的量不变 的量不变 |
B.反应速率加快,产生 的量不变 的量不变 |
C.反应速率不变,产生 的量增加 的量增加 |
D.反应速率加快,产生 的量减少 的量减少 |
已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量Q kJ,则乙炔燃烧的热化学方程式正确的是
| A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-2Q kJ·mol-1 |
| B.C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l);ΔH=2QkJ·mol-1 |
| C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-4Q kJ·mol-1 |
| D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=Q kJ·mol-1 |
在2L的密闭容器中发生下面反应:A(g)+2B(g)=3C(g),经过3min后A的物质由10mol变为7mol,则下面表示的反应速率正确的是
| A.vA=1mol·L-1·min-1 | B.vB=1mol·L-1·min-1 |
| C.vC=2mol·L-1·min-1 | D.vB=2mol·L-1·min-1 |
热化学方程式中化学式前的化学计量数表示()
| A.分子个数 | B.原子个数 | C.物质的质量 | D.物质的量 |