控制适合的条件,将反应2Fe3++2I-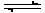 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是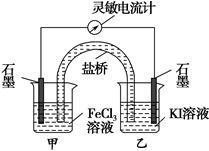
| A.反应开始时,乙中石墨电极上发生氧化反应 |
| B.反应开始时,甲中石墨电极上Fe3+被还原 |
| C.电流计读数为零时,反应达到化学平衡状态 |
| D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极 |
下列说法不正确的是:
| A.能量较高、有可能发生有效碰撞的分子称为活化分子 |
| B.活化分子的平均能量与所有分子的平均能量之差称为活化能 |
| C.催化剂能参与反应,可降低原反应所需活化能 |
| D.非活化分子也有可能发生有效碰撞 |
下列关于苯的说法中,不正确的是
| A.苯的分子式是C6H6,但不能使酸性KMnO4溶液褪色 |
| B.在催化剂作用下,苯与溴水反应生成溴苯,发生取代反应 |
| C.在一定条件下,苯也可以发生加成反应 |
| D.苯分子为平面正六边形结构,6个碳原子之间的键完全相同 |
已知反应:2H2(g)+O2(g)=2H2O(l);△H= -571.6kJ·mol-1,下列对于反应2H2O(l)=2H2(g)+O2(g)的说法不正确的是
| A.吸热反应 | B.△S>0 |
| C.只能在电解条件下进行 | D.在一定温度下可以自发进行 |
下列叙述中不正确的是
| A.由乙烯制备聚乙烯,发生了加聚反应 |
| B.聚乙烯是有机高分子化合物,加热时,存在一个固定的熔化温度 |
| C.同质量的乙烯和聚乙烯完全燃烧后生成的CO2的质量相等 |
| D.乙烯能使酸性高锰酸钾溶液褪色而聚乙烯不能 |
决定化学反应速率的根本因素是
| A.温度和压强 | B.反应物的浓度 | C.反应物的性质 | D.催化剂 |