已知:酸性H2CO3>HClO>HCO3-,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是
| A.c(Na+)>c(HCO3-)>c(H+)>c(OH-) |
| B.c(HCO3-)>c(ClO-)>c(OH-) |
| C.c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) |
| D.c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)+c(CO32-) |
下列关于氧化物的叙述正确的是 ( )
| A.能跟强碱溶液反应的氧化物就是酸性氧化物 | B.酸性氧化物都可以与水反应可生成酸 |
| C.金属氧化物不一定是碱性氧化物 | D.不能跟酸反应的氧化物一定能和碱反应 |
生活中遇到下列问题,不涉及到化学变化的是()
| A.蜂蚁蛰咬处涂抹稀氨水可解痛痒 | B.用四氯化碳可擦去圆珠笔油 |
| C.自来水厂用液氯消毒 | D.可用食醋洗掉水垢 |
用惰性电极电解2L、1mol/L的CuSO4溶液,在电路中通过0.5mol电子后,调换正、负极,电路中又通过了1mol电子,此时溶液中H+的浓度(假设溶液体积不变)是()
| A.1.5mol/L | B.0.75mol/L | C.0.5mol/L | D.0.25mol/L |
利用如图装置,能完成很多电化学实验。下列有关此装置的叙述中,不正确的是()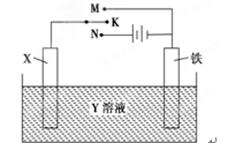
| A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法 |
| B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,溶液中的阳离子向铁电极移动 |
| C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动 |
| D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小 |
用铂电极电解100mL HNO3 与 AgNO3的混合液,通电一段时间后,两极均收集到
2.24 L气体(标准状况),则要使溶液复原则应加入()
| A.0.2molAg2O | B.0.2 mol H2O | C.0.4mol AgNO3. | D.0.2 molAgOH |