固体氧化物燃料电池是以固体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。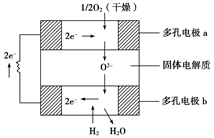
下列判断正确的是
| A.有O2参加反应的a极为电池的负极 |
| B.电路中每转移2mole-,则消耗H2的体积为22.4L. |
| C.a极对应的电极反应式为O2+2H2O+4e-=4OH- |
D.该电池的总反应式为2H2+O2 2H2O 2H2O |
在日常生活中出现了“加碘食盐”“增铁酱油”“高钙牛奶”“富硒茶叶”“含氟牙膏”等名词,这里的碘、铁、钙、硒、氟应理解为
| A.元素 | B.单质 | C.分子 | D.氧化物 |
有关天然产物水解的叙述不正确的是
| A.油脂水解为高级脂肪酸与丙三醇 |
| B.淀粉水解为葡萄糖 |
| C.蛋白质水解的最终产物均为氨基酸 |
| D.纤维素可以在人体内水解成葡萄糖 |
下表是食用碘盐包装上的部分说明,下列说法正确的是
| 配料 |
精盐、碘酸钾、抗结剂 |
| 碘含量 |
35±15 mg·kg-1 |
| 储存方法 |
密封、避光、防潮 |
| 食用方法 |
烹饪时,待食品熟后加入碘盐 |
A.高温会导致碘的损失
B.碘酸钾可氧化氯化钠
C.可用淀粉检验碘盐中的碘酸钾
D.该碘盐中碘酸钾含量为20~50 mg·kg-1
下列关于油脂的有关知识,说法不正确的是
| A.油脂都不能使溴水或酸性高锰酸钾溶液褪色 |
| B.油脂的饱和程度对油脂的熔点有着重要的影响 |
| C.油脂属于酯类物质 |
| D.食用油放在玻璃瓶中比放在塑料瓶中保存更科学 |
下列关于水在人体中的作用错误的是
| A.提供能量 |
| B.做营养物质水解的反应物 |
| C.做溶剂 |
| D.调节体温 |