反应A2+B2 2AB在不同条件下,产物AB百分含量随时间变化关系如图所示,a为500℃,b为300℃时情况,c为300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是
2AB在不同条件下,产物AB百分含量随时间变化关系如图所示,a为500℃,b为300℃时情况,c为300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是
| A.A2、B2、AB均为气体,正反应放热 |
| B.AB为气体,A2、B2中最少有一种为非气体,正反应放热 |
| C.AB为气体,A2、B2中最少有一种为非气体,正反应吸热 |
| D.AB为固体,A2、B2中最少有一种为非气体,正反应吸热 |
如图,图1为甲烷和O2构成的燃料电池,图2为电解MgCl2溶液装置。用该装置进行实验,反应开始后,观察到x电极附近出现白色沉淀。下列说法正确的是 ( ) 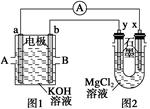
| A.A处通入的气体为O2,B处通入的气体为CH4 |
| B.电池内部K+向b极移动,OH-向a极移动 |
| C.图1装置中发生的总反应为:CH4+2O2===CO2+2H2O |
| D.图1、图2中电解质溶液的pH均增大 |
已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡,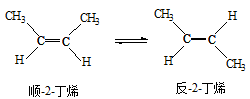
△H=-4.2 kJ/mol。下列说法正确的是()
| A.顺-2-丁烯比反-2-丁烯稳定 |
| B.顺-2-丁烯的燃烧热比反-2-丁烯大 |
| C.加压和降温有利于平衡向生成顺-2-丁烯反应方向移动 |
| D.反-2-丁烯和顺-2-丁烯具有相同的熔沸点 |
由A、B两种烃组成的混合物,当混合物质量一定时,无论A、B以何种比例混合,完全燃烧消耗氧气的质量为一恒量。对A、B两种烃的下面几种判断:①互为同分异构体;②互为同系物;③具有相同的最简式;④烃中碳的质量分数相同,一定正确的是( )
A.①②③④ B.①③④ C.②③④ D.③④
欲除漆包铜线表面的油漆,可将铜线放在酒精灯火焰上灼烧后,再将其放入某种试剂中,即可除净,该试剂是()
| A.乙醇 | B.醋酸 | C.硝酸 | D.硫酸 |
能促进水的电离,并使溶液中c(H+)>c(OH-)的操作是()
(1)将水加热煮沸 (2)向水中投入一小块金属钠 (3)向水中通CO2 (4)向水中通NH3 (5)向水中加入明矾晶体 (6)向水中加入NaHCO3固体(7)向水中加NaHSO4固体
| A.(1)(3)(6)(7) | B.(1)(3)(6) | C.(5)(7) | D.(5) |