一定条件下,在体积为3 L的密闭容器中反应:CO(g)+ 2H2(g)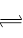 CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。

(1)根据右图,升高温度,K值将 (填“增大”、“减小”或“不变”)。
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是 (用nB、tB表示)。
(3)该可逆反应达到化学平衡状态的标志是 (填字母)。
a、CO、H2、CH3OH的浓度均不再变化
b、混合气体的密度不再改变
c、混合气体的平均相对分子质量不再改变
d、v生成(CH3OH)= v消耗(CO)
(4)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是 (填字母)。
a、c(H2)减少 b、正反应速率加快,逆反应速率减慢
c、CH3OH 的物质的量增加 d、重新平衡时c(H2)/ c(CH3OH)减小
(5)根据题目有关信息,请在右下坐标图中标示出该化学反应过程的能量变化(标明信息)。

(6)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为:2CH3OH +3O2+4OH- = 2CO32- + 6H2O,该电池中负极上的电极反应式是:
2CH3OH–12e-+16OH-= 2CO32-+ 12H2O ,则正极上发生的电极反应为: 。
某主族元素R的最高正化合价与最低负化合价的代数和为6,由此可以判断
| A.R可能是第二周期元素 |
| B.R一定是ⅥA族元素 |
| C.R的气态氢化物比同周期其它元素气态氢化物稳定 |
| D.R气态氢化物化学式为H2R |
下列物质中,既有离子键又有共价键的是
| A.CaCl2 | B.KOH | C.H2O | D.H2SO4 |
不能说明氧元素比硫元素非金属性强的事实是
| A.热稳定性H2O比H2S强 |
| B.H2S水溶液在空气中变浑浊 |
| C.H2O比H2S的沸点高 |
| D.在一定条件下,O2与Cu反应生成CuO,S与Cu反应生成Cu2S |
元素性质呈周期性变化的根本原因是
| A.核外电子排布呈周期性变化 | B.元素的相对原子质量逐渐增大 |
| C.核电荷数逐渐增大 | D.元素化合价呈周期性变化 |
在某无色溶液中,加入盐酸酸化的BaCl2溶液有白色沉淀,则下列判断正确的是
| A.一定有SO42- | B.可能有SO42-或Ag+ |
| C.一定有Ag+ | D.可能有SO32-或SO42- |