在氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象和结论一定正确的是
| A.加入有色布条,一会儿有色布条褪色。说明溶液中有Cl2存在 |
| B.溶液呈黄绿色,且有刺激性气味,说明有Cl2存在 |
| C.加入盐酸酸化,再加入硝酸银溶液产生白色沉淀,说明氯水中有Cl-存在 |
| D.加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在 |
在一定温度下,固定容积的容器中加入a mol A和b mol B,发生反应:A(g)+2B(g) 2C(g)一段时间后达到平衡,生成n mol C。则下列说法中不正确的是
2C(g)一段时间后达到平衡,生成n mol C。则下列说法中不正确的是
A.再充入少量A,平衡向正反应方向移动,但K值不变
B.起始时刻和达到平衡后容器中的压强之比为(a+b)∶(a+b-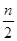 )
)
C.当2v正(A)=v逆(B)时,反应一定达到平衡状态
D.充入惰性气体(如Ar)增大压强,平衡向正反应方向移动
在容积相同的甲、乙两个密闭容器中,均分别充入2molSO2和1molO2,发生反应:2SO2+O2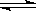 2SO3,在相同温度下,若甲容器始终保持体积不变,乙容器始终保持压强不变,达平衡时测得甲容器中SO2的转化率为25%,则乙容器中SO2的转化率
2SO3,在相同温度下,若甲容器始终保持体积不变,乙容器始终保持压强不变,达平衡时测得甲容器中SO2的转化率为25%,则乙容器中SO2的转化率
| A.25% | B.小于25% | C.大于25% | D.无法确定 |
以纯锌作阴极,以石墨作阳极,电解某浓度的硫酸锌溶液,阴极产物均附在电极上,通电一段时间后,关闭电源,迅速撤去电极(设阴极产物没有损耗),若在电解后的溶液中加入9.9g Zn(OH)2固体,则恰好能使溶液恢复到原浓度,则整个电解过程中,所产生的气体总体积为(标准状况)
| A.4.48L | B.1.12L | C.2.24L | D.3.36L |
短周期元素X、Y、Z、W的原子序数依次增大,X和Z同主族,Y和W同主族,原子半径X小于Y。下列叙述正确的是
| A.同周期元素中W的最高价氧化物对应水化物的酸性最强 |
| B.氢化物的热稳定性:HnY>HnW |
| C.Y和X、Z和X组成的常见化合物中化学键的类型相同 |
| D.原子半径的大小顺序: rW>rZ>rY>rX |
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,不满足图示转化关系的是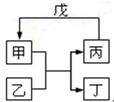
| 甲 |
乙 |
丙 |
戊 |
|
| ① |
NH3 |
O2 |
NO |
H2O |
| ② |
Fe |
H2O |
H2 |
Fe2O3 |
| ③ |
Al2O3 |
NaOH溶液 |
NaAlO2溶液 |
过量CO2 |
| ④ |
Na2O2 |
CO2 |
O2 |
Na |
A.①③B.②③ C.②④ D.①④