某同学购买了一瓶××牌“84消毒液”,查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO 1 000 mL、密度1.19 g·cm-3。
请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为 mol·L-1(保留两位有效数字)。
(2)某实验需用480 mL含25%NaClO的消毒液。该同学参阅该“84消毒液”的配方,欲用NaClO固体配制该消毒液。
①下列说法正确的是 。
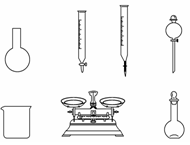
A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用久置的NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
②在配制过程中,下列操作可能使配制的溶液的浓度偏大的是 。
A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯
B.定容时,俯视刻度线
C.定容时,仰视刻度线
D.移液时,有少量液体溅出
(12分) 甲、乙、丙、丁四位同学在探究碱溶液与酚酞作用的实验时,发现了一个意外现象:氢氧化钠溶液滴入酚酞试液,溶液变成了红色,可是过了一会儿红色就消失了。
[猜想]
甲:可能是酚酞变质造成的;
乙:可能是氢氧化钠溶液与空气中的二氧化碳反应的缘故;
丙:可能是酚酞与空气中的氧气反应,使红色消失;
丁:可能与氢氧化钠溶液浓度大小有关。
[理论分析]
(1)甲同学刚提出自己的猜想,就遭到其余三位同学的否定,三位同学的理由是:
;
(2)丙同学认为乙同学的猜想也不正确,他的理由是
。
[实验设计]
(3)为证实丙同学的猜想,还需做如下实验,请完成下表:
| 实验步骤 |
设计这一步骤的目的 |
| 1.将配制的氢氧化钠溶液加热 |
|
| 2.在加热后的溶液中滴入酚酞,并在上方滴一些植物油 |
(4)通过以上实验,四位同学观察到的现象是:溶液先变成红色,过了一会儿红色仍然消失。因此酚酞红色褪去与氧气无关。若丁同学的猜想正确,大家能设计实验证明吗?
| 实验方法 |
可能观察到的现象和结论 |
| 方案一:分别配制不同物质的量浓度的氢氧化钠溶液,然后各滴加数滴酚酞溶液。 |
物质的量浓度大的溶液中酚酞红色消失 证明 |
| 方案二:向原红色消失的溶液中加 (填试剂名称) |
红色重新出现,则说明红色消失与氢氧化钠物质的量浓度大小有关 |
某学校设计了一节实验活动课,让学生从废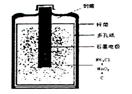
旧干电池回收碳棒、锌皮、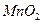 、
、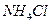 、
、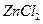 等物质,
等物质,
整个实验过程如下,请回答有关问题。
(1)有关干电池的基本构造和工作原理。右图是干电池的
基本构造图。干电池工作时负极上的电极反应式子是,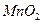
的作用是除去正极上的产物,本身生成Mn2O3,该反应的化学方程式是。
(2)锌皮和碳棒的回收。用钳子和剪子开回收的干电池的锌筒,将锌皮和碳棒取出,并用手刷刷洗干净,将电池内的黑色粉末移入小烧杯中。
(3)氧化铵、氯化锌的提取、检验和分离。
①如何从黑色粉末中提取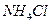 和
和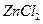 等晶体的混合物?写出简要的实验步骤。
等晶体的混合物?写出简要的实验步骤。
②设计简单的实验证明所得晶体中含有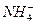 和
和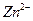 [一直
[一直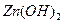 是两性氢氧化物且溶解于氨水],并且填写下列实验报告。
是两性氢氧化物且溶解于氨水],并且填写下列实验报告。
| 实验步骤 |
实验现象 |
实验结论 |
有关离子方程式 |
| (a) |
|||
| (b) |
(c) |
说明有 |
(d) |
| (e) |
(f) |
说明有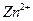 |
(a),(b),(c),(d),(e),(f),
(4)最后剩余的黑色残渣的主要成分是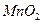 ,还有炭黑和有机物等。可用灼烧的方法除去杂质,该实验中需要用到的主要仪器除酒精灯外有(写其中2中即可)。
,还有炭黑和有机物等。可用灼烧的方法除去杂质,该实验中需要用到的主要仪器除酒精灯外有(写其中2中即可)。
氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质。请回答:
(1)实验室制取氨气的化学方程式是。
(2)①右图是进行氨气喷泉实验的装置,引发喷泉的操作步骤是。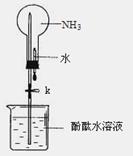
②氨气使烧杯中溶液由无色变为红色,其原因是_______________________________(用电离方程式表示)。
(3)该小组同学设计了下图所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物。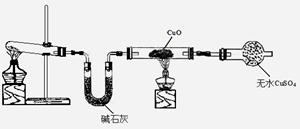
①实验现象为:黑色CuO变为红色;白色无水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式。
②碱石灰的作用是。
③该装置存在明显缺陷,请指出存在的问题并提出改进意见
。
(4)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+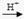 Cu + Cu2+)。
Cu + Cu2+)。
请你设计一个简单的实验检验该红色物质中是否含有Cu2O。
;
(5)工业废气中的氮氧化物是主要的大气污染物之一。为了治理污染,工业上常用氨气与之发生反应:NOx+NH3→N2+H2O,使其转化为无毒的N2 。现有NO2和NO的混合气体3.0 L,跟3.4 L(同温同压下)NH3反应,恰好使其全部转化为氮气,则原混合气体中,NO2与NO的体积比是__________。
(14分)已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(杂质与酸不反应)。某化学兴趣小组在实验室条件下以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
步骤一:电解精制:
电解时,粗铜应与电源的 ▲ _极相连,阴极上的电极反应式为▲。
电解过程中,硫酸铜的浓度会▲(选填:变大、不变、变小)。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式:▲ 。残渣含有极少量的黄金。为了回收金,他们查阅了有关资料(见下表):
| 序号 |
反应 |
化学平衡常数 |
| 1 |
Au + 6HNO3(浓)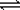 Au(NO3)3 + 3NO2↑+ 3H2O Au(NO3)3 + 3NO2↑+ 3H2O |
<< 1 |
| 2 |
Au3+ + 4Cl- ="" AuCl4- |
>>1 |
从资料中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你从化学平衡移动的角度简要解释金能够溶于王水的原因▲。
(2)滤液含量的测定:以下是该小组探究滤液的一个实验流程:
则100mL滤液中Cu2+的浓度为▲ mol·L-1,Fe2+的浓度为▲mol·L-1
某化学实验小组同学为了证明、比较SO2和氯水的漂白性,设计了如下图所示的实验装置。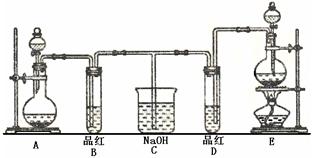
(1)实验室常选用制CO2的发生装置制SO2;实验室在用MnO2跟浓盐酸反应制备Cl2时,应选用上图A、E两发生装置中 ▲装置(填装置序号)制Cl2。在制Cl2的反应中浓盐酸所表现出的性质是 ▲。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪去,停止通气后,给B、D两个
试管加热,两个试管中的现象分别为B:▲,D:▲。
(3)装置C的作用是 ▲。
(4)甲乙两名同学分别利用下图所示装置探究两种气体按不同比例混合后的漂白性。试分析: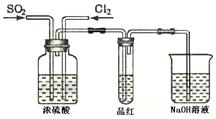
①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是: ▲。
②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是: ▲,并写出其相应的离子方程式: ▲。
③乙同学在实验过程中发现:通气一段时间后,品红溶液颜色随时间推移变得越来越浅,其原因是: ▲。