下列反应中必须加入还原剂才能实现的是
A.Fe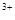 →Fe →Fe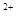 |
B.Zn→ Zn2+ | C.H 2→H2O | D.CuO→CuCl2 |
近年来,科学家研制了一种新型的乙醇电池,它用酸性电解质(H+)作溶剂。电池总反应为:C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是
| A.乙醇在电池的负极上参加反应 |
| B.1mol CH3CH2OH被氧化转移6mol e- |
| C.随着反应的进行,正极附近的酸性减弱。 |
| D.电池正极的正极反应为4H++O2+4e-=2H2O |
下列热化学方程式中,△H能正确表示物质的燃烧热的是
| A.2CO(g) +O2(g) ==2CO2(g) △H=—566.0 kJ/mol |
| B.C(s) +1/2O2(g) ==CO(g) △H=—110.5 kJ/mol |
| C.CH4(g) +2O2(g)="=" CO2(g)+2H2O(l) △H=—890.31 kJ/mol |
| D.2C8H18(l) +25O2(g)==16CO2(g)+18H2O(l) △H=—11036 kJ/mol |
对下列事实的解释正确的是
| A.氯气可以使湿润的有色布条褪色,是因为氯气具有漂白性 |
| B.用氢氟酸雕刻玻璃,是由于氢氟酸能与二氧化硅反应 |
| C.向50mL18mol·L-1的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45mol |
| D.常温下,浓硝酸可以用铝制容器贮存,说明铝与浓硝酸不反应 |
表示0.1mol·L-1NaHCO3溶液有关微粒浓度的关系正确的
| A.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
| B.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| C.c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-) |
| D.c(OH-)=c(H+)+c(H2CO3)+c(HCO3-) |
将等物质的量的X、Y气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:X(g)+3Y(g) 2Z(g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
2Z(g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
| 改变条件 |
新平衡与原平衡比较 |
|
| A |
升高温度 |
X的转化率变小 |
| B |
增大压强 |
X的浓度变小 |
| C |
充入一定量Y |
Y的转化率增大 |
| D |
使用适当催化剂 |
X的体积分数变小 |