下列有关氮元素及其化合物的表示正确的是
A.质子数为7、中子数为8的氮原子: |
B.氮离子(N3-)的结构示意图: |
C.氨分子的电子式: |
D.硝基苯的结构简式: |
下列描述中正确的是
| A.CS2为V形的极性分子 | B.ClO3-的空间构型为平面三角形 |
| C.SF6中的空间构型为正四面体形 | D.SiF4和SO32-的中心原子均为sp3杂化 |
下列各项比较中前者高于(或大于或强于)后者的是
| A.CCl4和SiCl4的熔点 |
B.邻羟基苯甲醛(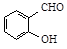 )和对羟基苯甲醛( )和对羟基苯甲醛(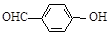 )的沸点 )的沸点 |
| C.SO2和CO2在水中的溶解度 |
| D.H2SO3和H2SO4的酸性 |
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是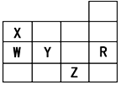
| A.常压下五种元素的单质中Z单质的沸点最高 |
| B.Y、Z的阴离子电子层结构都与R原子的相同 |
| C.W的氢化物的沸点比X的氢化物的沸点高 |
| D.Y元素的非金属性比W元素的非金属性强 |
下列说法不正确的是
| A.互为同分异构体的分子结构几乎完全相同 |
| B.丙氨酸CH3-CH(NH2)-COOH存在手性异构体 |
| C.标准状况下,相同体积的NH3 、CH4、HF含有相同的电子数 |
| D.等体积的CO和N2混合后所得的混合气体的平均摩尔质量为28 g/mol |
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
| A.SO2和SiO2 | B.CCl4和KCl | C.NaCl和HCl | D.CO2和H2O |