若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定不能大量共存的离子组是
| A.Al3+ Na+NO-3 Cl- | B.K+ Ba2+Cl- NO3- |
| C.K+ Na+ Cl-AlO2- | D.K+ Fe2+ SO42-NO3- |
以下分离或提纯的方法中正确的是()
| A.分离碘水中的碘——升华 | B.分离白酒中的酒精和水——分液 |
| C.除去海盐中的硫酸盐——溶解后加硝酸钡 | D.分离海水中的水——蒸馏 |
下列溶液中的Cl-浓度与50 mL 1 mol ·L-1 MgCl2溶液中的Cl-浓度相等的是()
| A.150 mL 1 mol·L-1 NaCl溶液 | B.75 mL 0.5mol·L-1CaCl2溶液 |
| C.150 mL 2 mol·L-1 KCl溶液 | D.75 mL 1 mol ·L-1AlCl3溶液 |
下列各项中表达正确的是()
A.F原子结构示意图: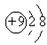 |
B.H2O的电子式: |
| C.1H、2H、3H是三种不同元素 | D.乙烯的分子式: C2H4 |
区别溶液和胶体最简单的方法是()
| A.观察外观 | B.丁达尔效应 | C.布朗运动 | D.加热 |
下列反应中,是吸热反应的是()
A.铝片与稀硫酸反应 B 乙醇在空气中燃烧
C.盐酸与氢氧化钠溶液反应 D 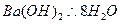 晶体与氯化铵晶体反应
晶体与氯化铵晶体反应