已知常温下,N2(气)和H2(气)反应生成4mol NH3(气)放出QkJ热量。现有甲、乙两个等体积的密闭容器,在常温下:①向密闭容器甲中通入2molN2和6 mol H2,达到平衡时放出热量Q1kJ。②向密闭容器乙中通入1 mol N2和3 mol H2,达到平衡时放出热量Q2kJ。则下列关系式正确的是
| A.Q1=2Q2=Q | B.Ql>2Q2 | C.Q1<2Q2 | D.Q1=2Q2≠Q |
室温下,0.1mol/L氨水10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是
①电离度增大 ②C(OH-)增大 ③C(H+)增大 ④KW增大⑤导电性增强⑥C(OH-)/C(NH3 ·H2O)增大
| A.①②③ | B.①③⑤ | C.①③⑥ | D.②④⑥ |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.常温常压下,17g羟基中含有的电子数目为10NA |
| B.常温常压下,28g由C2H4和C3H6组成的混合气体中含有的碳原子数目为2NA |
| C.0.05mol熔融的NaHSO4中含有的离子数目为0.15NA |
| D.标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA |
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是
| A.脱氧过程是吸热反应,可降低温度,延长糕点保质期 |
| B.脱氧过程中铁作原电池正极,电极反应为:Fe-3e→Fe3+ |
| C.脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e→4OH- |
| D.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
下列有关化学用语表示正确的是
A.中子数为20的氯原子: |
B.NH3分子的电子式: |
C.铝原子的结构示意图: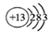 |
D.聚丙烯的结构简式为 |
分类是化学学习和研究的常用手段。下列分类依据和结论都正确的是
| A.H2O、HCOOH、(NH4)2Fe(SO4)2均含有氧,都是氧化物 |
| B.HCl、H2SO4、HNO3均具有氧化性,都是氧化性酸 |
| C.赤铁矿、磁铁矿、黄铁矿、孔雀石都是常见的铁矿石 |
| D.Na2CO3、Ba(OH)2、NH4Cl、Na2O2都属于离子化合物 |