相同温度下,体积均为1L的两个恒容密闭容器中发生可逆反应:
A(g)+2B(g) 2C(g) ΔH =a kJ·mol-1。(a>0)
2C(g) ΔH =a kJ·mol-1。(a>0)
实验测得起始、平衡时的有关数据如下表所示,下列叙述错误的是
| 容器 编号 |
起始时各物质的物质的量/mol |
达到平衡时 体系能量的变化 |
||
| A |
B |
C |
||
| ① |
1 |
2 |
0 |
吸收热量:0.25 akJ |
| ② |
0.5 |
1 |
1 |
吸收热量:Q kJ |
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中C的体积分数均约为18%
C.容器②中达到平衡时吸收的热量Q=0.25a kJ
D.若其他条件不变,把容器①的体积改为2L,则平衡时吸收的热量小于0.25a kJ
有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+)/mol·L-1为
| A.(y-2x)/a | B.(y-x)/a | C.(2y-2x)/a | D.(2y-4x)/a |
物质的量浓度相同的硝酸钾、硫酸钾、磷酸钾(K3PO4)三种溶液中,若使钾离子的物质的量相同,则这三种溶液的体积比为
| A.3:2:1 | B.6:3:2 | C.2:3:6 | D.1:2:3 |
X、Y、Z为三种单质。已知:Y能将Z从其化合物的水溶液中置换出来,而Z又能将X从其化合物中置换出来。由此可以推断下列说法中可能正确的是
①单质的氧化性:Y>Z>X;②单质的还原性:Y>Z>X;
③对应离子的氧化性:X>Z>Y;④对应离子的还原性:X>Z>Y
| A.只有① | B.只有②③ | C.只有①④ | D.①②③④ |
分类是科学研究的重要方法,下列物质分类不正确的是
| A.化合物:干冰,冰水混合物,烧碱,小苏打 |
| B.非电解质:乙醇,四氯化碳,氯气,葡萄糖 |
| C.同素异形体:活性炭,C60,C80,金刚石 |
| D.混合物:漂白粉,纯净矿泉水,分析纯盐酸,石灰石 |
对下列化学用语的理解正确的是
A.离子结构示意图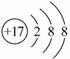 既可以表示35Cl-,也可以表示37Cl- 既可以表示35Cl-,也可以表示37Cl- |
B.电子式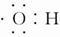 既可以表示羟基,也可以表示氢氧根离子 既可以表示羟基,也可以表示氢氧根离子 |
C.比例模型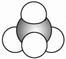 既可以表示甲烷分子,也可以表示四氯化碳分子 既可以表示甲烷分子,也可以表示四氯化碳分子 |
| D.结构简式(CH3)2CHCH3既可以表示正丁烷,也可以表示异丁烷 |