下列叙述正确的是
| A.常温下,反应C(s) + CO2(g)=2CO(g)不能自发进行,则该反应△H>0 |
| B.吸热反应必须加热才能发生,而放热反应可以不加热就能发生 |
| C.使用催化剂可以降低反应的活化能,改变反应的反应热,从而加快反应 |
| D.熵变(ΔS)大于零、焓变(ΔH)小于零的反应在任何条件下都一定能发生。 |
下列有关电解质溶液的说法正确的是 ( )。
| A.在蒸馏水中滴加浓H2SO4,KW不变 |
| B.CaCO3难溶于稀硫酸,也难溶于醋酸 |
| C.在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-) |
| D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
下列说法正确的是( )。
A.0.1 mol·L-1的醋酸溶液加水稀释, 减小 减小 |
| B.体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量),后者用时少 |
| C.向水中加入少量固体硫酸氢钠,c(H+)增大,KW变大 |
| D.常温下,V1 L pH=11的NaOH溶液与V2 L pH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
下列溶液一定呈中性的是 ( )。
| A.c(H+)=c(OH-)=10-6 mol·L-1的溶液 |
| B.pH=7的溶液 |
| C.使石蕊试液呈紫色的溶液 |
| D.酸与碱恰好完全反应生成正盐的溶液 |
在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。
zC(g),图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。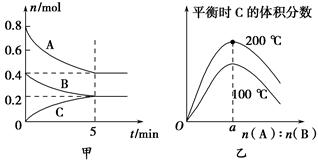
A.200 ℃时,反应从开始到平衡的平均速率v(B)=0.02 mol·L-1·min-1
B.由图乙可知,反应xA(g)+yB(g)zC(g)的ΔH<0,且a=2
C.若在图甲所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200 ℃时,向容器中充入2 mol A和1 mol B,达到平衡时,A的体积分数小于0.5
900 ℃时,向2.0 L恒容密闭容器中充入0.40 mol乙苯,发生反应: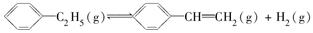 ΔH=a kJ·mol-1。经一段时间后达到平衡。反应过程中测定的部分数据见下表:
ΔH=a kJ·mol-1。经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| 时间/min |
0 |
10 |
20 |
30 |
40 |
| n(乙苯)/mol |
0.40 |
0.30 |
0.24 |
n2 |
n3 |
| n(苯乙烯)/mol |
0.00 |
0.10 |
n1 |
0.20 |
0.20 |
下列说法正确的是( )。
A.反应在前20 min的平均速率为v(H2)=0.008 mol·L-1·min-1
B.保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08 mol·L-1,则a<0
C.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率为50.0%
D.相同温度下,起始时向容器中充入0.10 mol乙苯、0.10 mol苯乙烯和0.30 mol H2,达到平衡前v正>v逆