下列指定反应的离子方程式正确的是
A.MnO2与浓盐酸混合加热:MnO2+4H++2Cl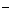  Mn2++Cl2↑+2H2O Mn2++Cl2↑+2H2O |
B.(NH4)2Fe(SO4)2溶液中加入过量的NaOH溶液:Fe2++2OH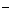 =Fe(OH)2↓ =Fe(OH)2↓ |
C.Ba(HCO3)2溶液中加入稀硫酸:Ba2+ + SO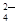 = BaSO4↓ = BaSO4↓ |
D.H2C2O4(弱酸)溶液中加入酸性KMnO4溶液:2MnO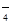 + 5H2C2O4= 2Mn2+ + 10CO2↑+ 2H2O + 6OH + 5H2C2O4= 2Mn2+ + 10CO2↑+ 2H2O + 6OH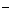 |
若某原子在处于能量最低状态时,外围电子排布为4d15s2,则下列说法正确的是
| A.该元素原子处于能量最低状态时,原子中共有3个未成对电子 |
| B.该元素原子核外共有5个电子层 |
| C.该元素原子的M能层共有8个电子 |
| D.该元素原子最外层共有3个电子 |
下列关于砷(As)元素的叙述中,正确的是
| A.在AsCl3分子中,砷原子最外层电子数为8 |
| B.Na3AsO4溶液的pH大于7 |
| C.砷的氢化物的化学式为AsH3,它是一种强氧化剂 |
| D.砷的相对原子质量为74.92,由此可知砷原子核内有42个中子 |
A、B都是短周期元素,原子半径B>A,它们可形成化合物AB2,由此下列判断正确的是
A.原子序数:A<B B.A和B可能在同一主族
C.A可能在第2周期ⅣA族 D.A肯定是金属元素
短周期元素R的原子核外电子数等于核内中子数,该元素单质7.8 g与氧气充分反应可生成13 g化合物RO,则该元素的价电子层是
| A.1s2 | B.2s2 | C.3s2 | D.4s2 |
下列指定微粒的个数比为2:1的是
| A.Be2+中的质子和电子 | B.NaHCO3晶体中的阳离子和阴离子 |
| C.H原子中的中子和质子 | D.BaO2(过氧化钡)固体中的阴离子和阳离子 |