如图所示,甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O。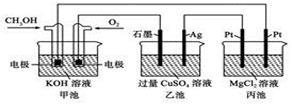
下列说法正确的是
| A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化为电能的装置 |
| B.甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O=CO32-+8H+ |
| C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 |
| D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上产生1.45 g固体 |
将一定质量的Zn、Al混合物与足量稀H2SO4反应,生成H2 6.72L(标准状况),原混合物的质量可能是
| A.2g | B.14g | C.20g | D.4.6 g |
下列叙述正确的是
| A.同温同压下,相同体积的气体,其物质的量不一定相等 |
| B.任何条件下,等物质的量的氢气和一氧化碳所含的分子数一定相等 |
| C.1 L一氧化碳气体一定比1 L氧气的质量小 |
| D.相同条件下的一氧化碳气体和氮气,若体积相等,则质量不一定相等 |
下列对某些离子的检验及结论一定正确的是
| A.先加入BaCl2溶液,产生白色沉淀,再加入HNO3溶液,白色沉淀不溶解,则溶液中一定含有大量的SO42﹣ |
| B.用洁净的铂丝蘸取待测液,置于酒精灯火焰上灼烧,观察到火焰呈黄色,则表明待测液中一定含有Na+而不含K+ |
| C.加入盐酸,能产生使澄清石灰水变浑浊的气体,则溶液中一定含有CO32﹣ |
| D.加入氯化钠溶液,有白色沉淀产生,再加入稀硝酸沉淀不消失,一定有Ag+ |
常温下,在溶液中可发生以下反应:①2Fe2++ Br2= 2Fe3+ + 2Br-,
②2Br-+ Cl2=Br2 + 2Cl-, ③2Fe3+ + 2I-= 2Fe2++ I2;由此判断下列说法错误的是
| A.铁元素在反应①中被氧化,在③中被还原 |
| B.反应②中当有1 mol Cl2被还原时,有2 mol Br-被氧化 |
| C.氧化性强弱顺序为:Cl2 > I2 > Br2 > Fe3+ |
| D.还原性强弱顺序为:I- > Fe2+ > Br- > Cl- |
有两种金属组成的混合物粉末20g与足量的稀盐酸反应,生成22.4L(标准状况)H2,则该混合物的组成可能是
| A.Fe 和Zn | B.Al和Cu | C.Na和Mg | D.Mg和Fe |