对于可逆反应mA + nB  pC +qD从正反应开始反应并在一定条件下达到平衡后,如果增大压强,则容器内气体平均相对分子质量增大,下列有关判断错误的是
pC +qD从正反应开始反应并在一定条件下达到平衡后,如果增大压强,则容器内气体平均相对分子质量增大,下列有关判断错误的是
| A.反应物A或B至少有一个是气体 |
| B.容器内不可能是单一气体 |
| C.m+n可能大于p+q |
| D.若m<p,且D是气体,则B一定是气体 |
下列与化学反应能量变化相关的叙述不正确的是
| A.化学反应是旧键断裂和新键形成的过程 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH相同 |
下列各图所表示的反应是吸热反应的是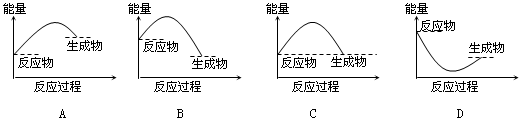
向足量H2SO4溶液中加入100 mL 0.4 mol·L-1 Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入100 mL 0.4 mol·L-1盐酸时,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为
| A.Ba2+(aq)+SO42-(aq)=BaSO4(s)ΔH=-2.92 kJ·mol-1 |
| B.Ba2+(aq)+SO42-(aq)=BaSO4(s)ΔH=-18 kJ·mol-1 |
| C.Ba2+(aq)+SO42-(aq)=BaSO4(s)ΔH=-73 kJ·mol-1 |
| D.Ba2+(aq)+SO42-(aq)=BaSO4(s)ΔH=-0.72 kJ·mol-1 |
根据下列热化学方程式,判断氢化物的稳定性顺序正确的是
N2(g)+3H2 (g)=2NH3(g)ΔH=-92.38 kJ·mol-1
H2(g)+Cl2(g)=2HCl(g)ΔH=-184.72 kJ·mol-1
I2(g)+H2(g)=2HI(g)ΔH=+51.92 kJ·mol-1
| A.HI>HCl>NH3 | B.HCl>NH3>HI |
| C.HCl>HI>NH3 | D.NH3>HI>HCl |
已知:S(l)+O2(g)=SO2(g) ΔH=-293.23 kJ·mol-1,分析下列说法中正确的是
| A.S(s)+O2(g)=SO2(g),反应放出的热量大于293.23 kJ·mol-1 |
| B.S(g)+O2(g)=SO2(g),反应放出的热量小于293.23 kJ·mol-1 |
| C.1 mol SO2(g)的键能的总和小于1 mol S(l)和1 mol O2(g)的键能之和 |
| D.1 mol SO2(g)的键能的总和大于1 mol S(l)和1 mol O2(g)的键能之和 |