右图是硫酸试剂瓶标签上的内容。

(1)该硫酸的物质的量浓度为 ;
(2)实验室用该硫酸配制240mL0.46 mol·L-1的稀硫酸,则
①需要该硫酸的体积为 mL;
②实验所用到的玻璃仪器除烧杯、玻璃棒外,还有 ;
③配制过程中有几个关键的步骤和操作如下图所示:将上述实验步骤A—F按实验过程先后次序排列 。
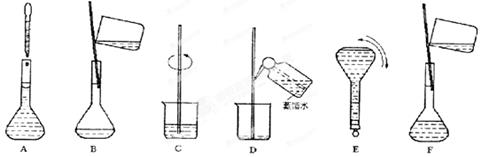
④该同学实际配制得到的浓度为0.45 mol·L-1,可能的原因是
| A.量取浓H2SO4时仰视刻度 |
| B.容量瓶洗净后未经干燥处理 |
| C.没有将洗涤液转入容量瓶 |
| D.定容时仰视刻度 |
NaHCO3和Na2CO3·xH2O的混合物,为了测定x值,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量)。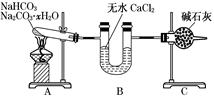
(1)A装置的作用是____________________________。
(2)B装置的作用是____________________________。
(3)C装置的作用是____________________________。
(4)若在装置A的试管中装入NaHCO3和Na2CO3·xH2O的混合物3.7 g,用酒精灯加热到反应完全,此时B管增重1.89 g,C管增重0.22 g,则x的值为。
(5)该装置还不是很完善,可能使测定结果偏小,应如何改进________。为什么?
测定生成SO3的转化率可以用下图装置,装置中烧瓶内发生的化学反应方程式为:Na2SO3(s)+H2SO4(85%)=Na2SO4+H2O+SO2↑(已知SO3的熔点是16.8oC,沸点是44.8oC)
(1)装置中甲管的作用是__________________。
(2)根据实验需要,应该在I、II、III、IV处连接合适的装置,请从下图A〜E装置中选择最适合装置并将其序号填至下面的空格中,每个装置不重复使用。
I、 II、III、IV处连接的装置分别是。
(3)为使SO2有较高的转化率,实验中加热催化剂与滴加浓硫酸的顺序中,应采取的操作是____________ ,若用大火加热烧瓶时,SO2的转化率会____________ (填“升高”、“不变”或“降低”)。
(4)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象不明显,但又不存在气密性问题,请你推测可能的原因(可以不填满)①原因:______ ②原因 :______③原因:______
(5)将SO2通入含1mol氯酸的溶液中,可生成一种强酸和一种氧化物,并有6.02×1023个电子转移,则该反应的化学方程式为
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置IV增重了 mg,则实验中SO2的转化率为。(用含m、n的代数式填写)
某课外活动小组的同学在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫;而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,且该反应装置已略去):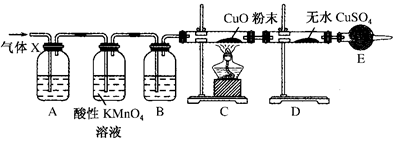
试回答:
(1)上述实验中生成二氧化硫气体的化学反应方程式为
_________________________________________________________。
(2)乙同学认为还可能产生氢气的理由是____________________ _____________________________________。
(3)丙同学在安装好装置后,必不可少的一步操作___________________________________________。
(4)B中加入的试剂是________,其作用是___________________ _____________________________________。
(5)可以证明气体X中含有氢气的实验现象是:C中________,D中________。如果撤去装置B,是否还能根据D中的现象判断气体X中含有氢气?
答: ___________________________________________________。
某化学兴趣小组为了探究常温下某非金属氧化物形成的未知气体的成分。该小组成员将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想。
【提出猜想】
猜想1:____________________________________;
猜想2:____________________________________;
猜想3:____________________________________。
为了验证猜想,该小组设计实验加以探究:
【实验探究】
该小组同学按如图所示装置,将气体从a端通入,则: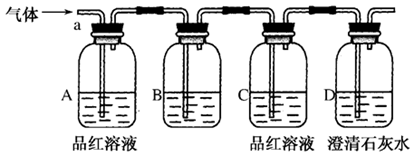
(1)B中应该装下列________试剂(填编号)。
| A.NaCl溶液 | B.酸性KMnO4溶液 | C.盐酸 | D.澄清石灰水 |
(2)A中品红溶液的作用是:
_____________________________________________。
(3)D中澄清石灰水的作用是:
_________________________________________________。
通过该实验,该小组同学观察到以下三个实验现象:①A中品红溶液褪色,②C中品红溶液不褪色③D中澄清石灰水变浑浊
【得出结论】
(4)由上述现象该小组同学确认该气体的成分为:_______________。
某石灰石块状样品中含有不溶于酸的杂质,拟用下图所示装置测定其中CaCO3的质量分数。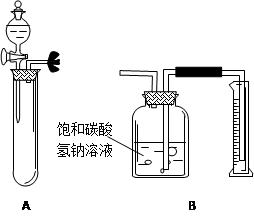
回答下列问题:
(1)写出检验A装置气密性的一种简单操作方法。
(2)将样品加入试管A的正确方法是。
(3)用托盘天平称取样品Wg,若所用天平游码标尺最大量程为5g,则与此天平配套的砝码中最小的砝码质量(选填编号字母)。
A.1g B.2g C.5g D.10g
(4)在读取量筒内液面读数时应注意(选填编号字母)。
A.视线与凹液面最低处相平 B. 视线与凹液面弧线相切
C.读数时应使广口瓶内液面与量筒内液面相平
D. 读数时不一定使广口瓶内液面与量筒内液面相平