已知热化学方程式:
H2O(g) = H2(g) +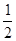 O2(g) △H =" +241.8" kJ·mol-1
O2(g) △H =" +241.8" kJ·mol-1
H2(g)+ 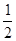 O2(g) = H2O(1) △H = -285.8 kJ·mol-1
O2(g) = H2O(1) △H = -285.8 kJ·mol-1
当18g液态水变为水蒸气时,其热量变化是
| A.吸热44 k J | B.吸热88kJ | C.放热44kJ | D.吸热2.44 kJ |
为除去CO2气体中混有的少量杂质SO2气体,应选用的试剂是()
| A.Na2CO3溶液 | B.NaHCO3溶液 | C.NaOH溶液 | D.NaHSO3溶液 |
在8NH3+3Cl2====6NH4Cl+N2反应中,若有2 mol N2生成,发生氧化反应的NH3的物质的量是 ( )
| A.16 mol | B.8 mol | C.4 mol | D.3 mol |
一定量的浓硝酸与过量的铜充分反应,生成的气体是()
| A.只有NO2 | B.只有NO | C.NO2和NO | D.NO2和H2 |
下列关于浓硝酸和浓硫酸的叙述正确的是()
| A.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 |
| B.浓硝酸具有不稳定性,实验室里应保存在棕色瓶中 |
| C.常温下,浓硝酸可以跟铜缓慢反应,浓硫酸可与铜片迅速反应 |
| D.实验室可以用浓硝酸来制氢气 |
下列各组物质属于同素异形体的是( )
| A.16O和18O | B.金刚石、石墨和富勒烯(C60) |
| C.NaCl和KCl | D.H2O和H2O2 |