下列的离子方程式正确的是
| A.用大理石跟稀盐酸制二氧化碳:CO32﹣+2H+═H2O+CO2↑ |
| B.Cu丝伸入到AgNO3溶液中:Cu+Ag+═Cu2++Ag |
| C.氧化镁与盐酸混合:MgO+2H+=Mg2++H2O |
| D.H2SO4溶液中滴入Ba(OH)2溶液:OH﹣+H+═H2O |
下列有关电解质溶液中粒子浓度关系正确的是
| A.pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③ |
| B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
| C.CO2的水溶液:c(H+)>c(HCO3-)=2c(CO32-) |
| D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
下列关于乙酸的说法不正确的是
| A.食醋中含有3%~5%的乙酸 |
| B.黄酒变酸是因为部分乙醇氧化为乙酸 |
| C.与甲酸甲酯互为同分异构体 |
| D.通过乙酸乙酯的碱性水解直接获取 |
将足量的CO2通入下列溶液中,最终溶液浑浊的是
①饱和苏打溶液 ②水玻璃 ③氯化钡 ④次氯酸钙
| A.①② | B.③④ | C.②③ | D.①②③④ |
向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。下列说法不正确的
A.a点的溶液呈酸性的原因为:NH4++H2O NH3·H2O+H+ NH3·H2O+H+ |
| B.c点沉淀的质量比a点沉淀的质量大 |
| C.b点加入Ba(OH)2溶液的体积为150 mL |
| D.至c点完成反应,反应的离子方程式可表示为: |
Al3++2SO42-+NH4++2Ba2++5OH-= AlO2-+2BaSO4↓+NH3·H2O+2H2O
常温下,用 0.2mol•L-1HCl溶液滴定10mL浓度为0.2mol•L-1 Na2CO3溶液,所得滴定曲线如图所示。下列说法不正确的是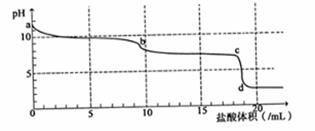
| A.a点时:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-) |
| B.当盐酸加入5mL时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-) |
| C.当盐酸加入10mL时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| D.b-c段发生的反应为:HCO3-+H+= CO2↑+H2O |