下列关于纯净物、混合物、强电解质、弱电解质、非电解质的组合正确的是
| |
纯净物 |
混合物 |
强电解质 |
弱电解质 |
非电解质 |
| A |
大理石 |
玻璃 |
氯化钾 |
高氯酸 |
干冰 |
| B |
盐酸 |
水煤气 |
硫酸 |
醋酸 |
氯气 |
| C |
明矾 |
硅酸盐水泥 |
苛性钠 |
亚硫酸 |
熟石灰 |
| D |
冰醋酸 |
漂白粉 |
BaSO4 |
氟化氢 |
氨气 |
下列有关物质分离方法的叙述中,不正确的是
| A.用过滤的方法分离溶液和胶体 | B.用蒸馏的方法将自来水制成蒸馏水 |
| C.用四氯化碳萃取碘水中的碘 | D.用加热的方法分离氯化钠和氯化铵固体 |
根据下列实验内容得出的结论正确的是
| 选项 |
实验内容 |
结论 |
| A |
某物质的水溶液能使红色石蕊试纸变蓝 |
该物质一定是氨气 |
| B |
某气体能使湿润的淀粉碘化钾试纸变蓝 |
该气体一定是氯气 |
| C |
某物质的水溶液中加入盐酸产生无色无气味气体 |
该溶液一定含有大量碳酸根离子 |
| D |
向铁和稀硝酸反应后的溶液中滴加KSCN溶液,溶液显红色 |
反应后溶液中肯定有Fe3+,可能还有Fe2+ |
25℃时,几种弱酸的电离常数如下:
| 弱酸化学式 |
CH3COOH |
HCN |
H2S |
| 电离常数(25℃) |
1.8×10-5 |
4.9×10-10 |
K1= 1.3×10-7 K2= 7.1×10-15 |
25℃时,下列说法正确的是
| A.等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) |
| B. a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)> c(CN-),则a一定大于b |
| C. NaHS和Na2S混合溶液中,一定存在c(Na+)+ c(H+)="=" c(OH-)+ c(HS-)+2c(S2-) |
| D.某浓度HCN的水溶液pH=d,则其中c(OH-)=10-d mol/L |
某课外实验小组设计的下列实验不合理的是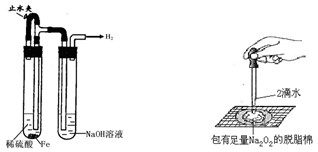
| A.制备并观察氢氧化亚铁 | B.证明过氧化钠与水反应放热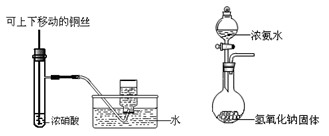 |
| C.制备并收集少量NO2气体 | D.实验室制备少量氨气 |
下列叙述正确的是
①在CaCl2和NH4Cl中均既含有共价键又含有离子键;②用蒸馏水即可鉴别甲苯、乙醇和四氯化碳三种无色液体;③KAl(SO4)2与Ba(OH)2溶液按照溶质的物质的量之比1:2混合,充分反应后,所得溶液呈中性;④除去混在SiO2中的少量CaCO3可加足量盐酸并过滤。
| A.①③ | B.②④ | C.①②④ | D.②③④ |