以A和乙醇为基础原料合成香料甲的流程图如下:
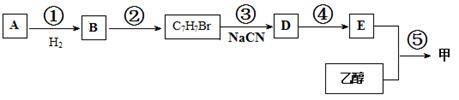
已知:R—Br+NaCN → R—CN+NaBr;R—CN 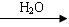 R—COOH
R—COOH
杏仁中含有A,A能发生银镜反应。质谱测定,A的相对分子质量为106。5.3g A完全燃烧时,生成15.4 g CO2和2.7 g H2O。
(1)A的分子式___ _ 其苯环的一氯代物共有 _种
(2)反应③的反应类型是___ ___
(3)写出反应②与⑤的化学方程式___ __、____ __
(4)5.3 g A加入至足量新制氢氧化铜悬浊液中,加热充分反应,制得砖红色沉淀的质量为 g。
已知:

用苯为原料合成化合物Ⅳ的线路如下: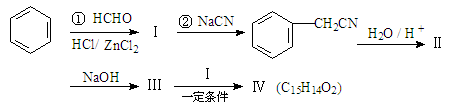
其中:Ⅱ是羧酸。请回答下列问题:
(1)②的反应类型是。
(2)写出同时符合下列条件的化合物Ⅱ的同分异构体结构简式(写2种),。
a.能与FeCl3溶液作用显紫色,
b.能发生银镜反应,
c.核磁共振氢谱除苯环峰外还有三组峰,峰面积之比为为1:2:1。
(3)1mol化合物Ⅳ完全燃烧消耗O2mol,化合物Ⅳ的结构简式是。
(4)化合物Ⅱ与乙醇、浓硫酸共热,合成一种香精原料,试写出该反应的化学方程式。
(5)①也是卤烷基化反应,写出该反应的化学方程式。
【化学—选修5有机化学基础】酯类化合物在医药和涂料等应用广泛。
(1)某有机物X的结构简式如右图所示,则下列有关说法正确的是 (多选)
| A.X在一定条件下能发生加成反应、加聚反应和取代反应 |
| B.在Ni催化下,1 mol X最多只能与5 mol H2加成 |
| C.可用酸性高锰酸钾溶液区分苯和X |
| D.X核磁共振氢谱有10个吸收峰 |
(2)固定CO2能有效利用资源、减缓温室效应并制备某些酯类。某高分子F可用下列途径制得:
化合物A分子式为 ,1mol化合物A完全燃烧需要消耗 mol O2 。
(3)化合物A可由芳香族化合物Ⅰ或Ⅱ通过消去反应获得,但只有Ⅰ能与Na反应产生H2,则化合物Ⅰ的结构简式为 (任写一种);由化合物Ⅱ生成A的反应方程式是 。
(4)写出由D与足量NaOH溶液反应生成E的化学反应方程式: 。
(5)化合物E与B形成高分子化合物的反应方程式是:_______________。
(15分)下列关系图中,A是一种酸式盐,D的分子式比C的大16,E是酸,当X无论是强酸或强碱都有如下反应关系:
当X是强酸时,A、B、C、D、E均含同一元素;
当X是强碱时,A、B、C、D、E均含另一元素。
回答下列问题(用化学式)
(1)A是_______,Y是_______ ,Z是_______
(2)当X是强酸时,B是__________,E是_________。
(3)当X是强碱时,B是__________,E是_________。
(4)写出A与X反应的离子方程式:
①__________________________。(X是强酸时)
②____________________________。(X是强碱时),在实验室制取B的化学方程式是____________,检验该物质的方法是________,收集方法的___________。
选考【化学—选修5有机化学基础】萜品醇可作为消毒剂、抗氧化剂、医药和溶剂。合成a-萜品醇G的路线之一如下:
已知:
请回答下列问题:
(1)A所含官能团的名称是________________(写出两个中任意一个)。
(2)A催化氢化得Z(C7H12O3),写出Z在一定条件下聚合反应的化学方程式:
____________________________________________________________________。
(3)B的分子式为_________;写出同时满足下列条件的B的链状同分异构体的结构简式:_____________。①核磁共振氢谱有2个吸收峰
②能发生银镜反应
(4)B → C、E → F的反应类型分别为_____________、_____________。
(5)C →D的化学方程式为______________________________________________。
(6)试剂Y的结构简式为______________________。
某校化学兴趣小组通过以下路线合成某镇静药物F: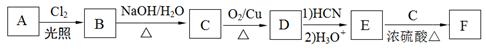
已知:
①A属于苯的同系物,1molA完全燃烧需要9mol氧气;
②B核磁共振氢谱表明分子中有4种化学环境的氢,峰面积之比为2:2:2:1;
③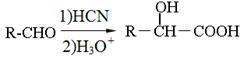 。
。
(1)A中碳原子的杂化轨道类型有______;D分子中的官能团名称为_______,检验该官能团的化学试剂是_________________;(填名称)
(2)B转化为C的化学方程式为_________________________;
(3)E与C反应生成F的化学方程式为_______________,反应类型为_____________。
(4)2分子E反应生成一种含有3个6元环的有机物,该有机物的结构简式为_________。
(5)E有多种同分异构体,其中符合下列条件的同分异构体有几种___________。
①其水溶液遇FeCl3溶液呈紫色;
②苯环上有2个取代基;
③能发生银镜反应