(一)糖类、油脂、蛋白质都是人体必需的营养物质。
(1)油脂被摄入人体后,在酶的作用下水解为高级脂肪酸和 (写名称),进而被氧化生成二氧化碳和水并提供能量,或作为合成人体所需其他物质的原料。
(2)氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(-NH2)和 写结构简式或名称)。人体中共有二十多种氨基酸,其中人体自身 (填“能”或“不能”)合成的氨基酸称为人体必需氨基酸。
(3)淀粉在淀粉酶的作用下最终水解为葡萄糖(C6H12O6),部分葡萄糖在体内被氧化生成二氧化碳和水。写出葡萄糖在体内被氧化的化学方程式: 。
(二)(1)2009年底在丹麦哥本哈根召开了全球气候会议,环境问题已受到世界各国的普遍关注。请回答:(1)现有①氟氯烃、②二氧化碳 、③二氧化硫 、④废弃塑料制品 、⑤氮气。
能形成酸雨的是 (填序号,下同);能破坏臭氧层的是 ;导致温室效应的主要气体是 。
(2)“白色污染”的主要危害是 (填序号)。
①破坏土壤结构 ②降低土壤肥效 ③污染地下水 ④危及海洋生物的生存
(3)2010年5月至10月在上海举办的世博会中倡导“低碳世博”。下列做法不能体现低碳生活的是 (填序号)。①减少食物加工过程 ②注意节约用电 ③尽量购买本地的、当季的食物 ④大量使用木柴为
(三)糖类、油脂、蛋白质能在人体中 (填“氧化” 或“还原” ),供给人体所需要的能量。其中 是含热能最高的营养物质。根据溶解性的不同,维生素B类属于 溶性维生素(填A、水;B、脂)。某药品标签上贴有“OTC”符号,它表示 。
生活中常用的某种香料X的结构简式为: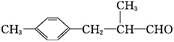
(1)香料X中含氧官能团的名称是。
(2)香料X可发生的反应类型是(填代号)。
a.酯化反应 b.还原反应
c.加成反应 d.消去反应
(3)已知: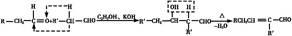
香料X的合成路线如下: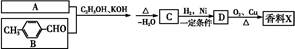
①A的结构简式是。
②检验有机物C中含有碳碳双键所需用的试剂。
a.银氨溶液 b.酸性高锰酸钾溶液
c.溴水 d.氢氧化钠溶液
③D→X的化学方程式为。
④有机物B的某种同分异构体E,具有如下性质:
a.与浓溴水反应生成白色沉淀,且1 mol E最多能与4 mol Br2反应
b.红外光谱显示该有机物中存在碳碳双键
则E的结构简式为。
某芳香族化合物A苯环上只有一个取代基,发生的反应如图所示,B、F、G的分子式分别为C2H4O2、H2C2O4、C6H12O,H能使溴水褪色。
(1)A的结构简式,H的键线式。
(2)B中的官能团名称为,⑤的反应类型为。
(3)C在一定条件下形成高分子化合物的化学方程式。
(4)足量G与F反应的化学方程式。
(5)G的同分异构体中能发生银镜反应的共有种,其中核磁共振氢谱有三组特征峰的有机物结构简式为。
决定物质性质的重要因素是物质结构,请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
578 |
1 817 |
2 745 |
11 578 |
| B |
738 |
1 451 |
7 733 |
10 540 |
A通常显价,A的电负性B的电负性(填“>”、“<”或“=”)。
(2)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因。
组成蛋白质的最简单的氨基酸中的碳原子杂化类型是。
| 共价键 |
C—C |
C—N |
C—S |
| 键能/kJ·mol-1 |
347 |
305 |
259 |
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),已知3种离子晶体的晶格能数据如下表:
| 离子晶体 |
NaCl |
KCl |
CaO |
| 晶格能/kJ·mol-1 |
786 |
715 |
3 401 |

则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有个。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是。
(5)某配合物的分子结构如图所示,其分子内不含有(填序号)。
A离子键;B极性键;C金属键;D配位键;E氢键;F非极性键
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为,该元素的符号是。
(2)Y元素原子的电子排布图为,元素X与Y的电负性比较:XY(填“>”或“<”)。
(3)X与Z可形成化合物XZ3,该化合物的空间构型为。
(4)由元素X与镓元素组成的化合物A为第三代半导体。已知化合物A的晶胞结构如图所示。(黑球位于立方体内,白球位于立方体顶点和面心)
请写出化合物A的化学式;化合物A可由(CH3)3Ga和AsH3在700 ℃下反应制得,反应的化学方程式为。
(5)已知(CH3)3Ga为非极性分子,则其中镓原子的杂化方式为。
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。A原子L层的成对电子数和未成对电子数相等,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是(用对应的元素符号表示);基态D原子的电子排布式为。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取杂化;B 的空间构型为(用文字描述)。
的空间构型为(用文字描述)。
(3)1 mol AB-中含有的π键个数为。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比是。
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=(填数值);氢在合金中的密度为。