为了检验某FeCl2溶液是否变质,可向溶液中加入
| A.石蕊溶液 | B.铁片 | C.氯水 | D.KSCN溶液 |
某短周期元素其原子核外最外层电子数为其内层电子数的两倍,则有关说法正确的是
| A.该元素在自然界中仅以化合态存在 |
| B.植物的光合作用在该元素在自然界的循环过程中起非常重要的作用 |
| C.其单质不能与任何酸发生化学反应 |
| D.其最高价氧化物不支持任何物质的燃烧,可以灭火 |
化学与生产、生活密切相关,下列表述正确的是
| A.一些劣质瓶装水中溴酸盐超标,长时间饮用可能致癌 |
B.日本东部地震造成了核电站的核泄漏,释放了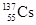 ,其所含的中子数为137 ,其所含的中子数为137 |
| C.由于氮原子不易得失电子,所以氮气化学性质稳定,可用于一些农作物、食品等的保存 |
| D.为减少碘元素缺乏引领疾病,我国目前在市售食盐中强制加入碘单质以补充居民碘摄入量 |
实验室用Zn和盐酸制备H2,将m1 g锌加入到m2 g 20%的盐酸中去,反应结果共放出nL氢气(标准状况),则被还原的HCl的物质的量一定是
| A.0.2m2/36.5 mol | B.m1/36.5 mol | C.m2/36.5 mol | D.n/11.2 mol |
咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示,下列叙述不正确的是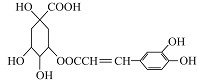
| A.咖啡鞣酸与浓溴水既能发生取代反应又能发生加成反应 |
| B.咖啡鞣酸分子中与苯环直接相连的原子都在同一平面上 |
| C.1 mol咖啡鞣酸在碱性条件下水解时,可消耗8 mol NaOH |
| D.咖啡鞣酸的分子式为C16H18O9 |
下列说法正确的是
A.某酸H2A的钠盐NaHA溶液中:c(H2A)>c(A2-),则该溶液的pH>7
B.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:2 c(Na+)=c(CH3COO-)
C.饱和Ca(OH)2溶液中加入一定量的生石灰,恢复至原来的温度,所得溶液的pH会增大
D.0.2 mol·L-1 NH4NO3和0.l mol·L-1 NaOH溶液等体积混合后:
c(NH4+)>c(NO3-)>c(Na+)>c(OH-)>c(H+)