在101kPa时,测得氢气燃烧的热化学方程表示式如下:
①2H2 (g)+O2(g)=2H2O(1) △H=-571.6kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H= -483.6kJ/mol
则H2的燃烧热为
| A.-285.8kJ/ mol |
| B.285.8kJ/mol |
| C.-241.8 kJ/ mol |
| D.241.8kJ/md |
下列方法中,不能用于实验室制备氨气的是
| A.加热浓氨水 |
| B.将浓氨水滴到生石灰上 |
| C.加热氯化铵固体 |
| D.将熟石灰和氯化铵的混合物加热 |
下列措施不能够使化学反应速率加快的是
| A.升高温度 | B.降低温度 |
| C.使用催化剂 | D.增大固体反应物面积 |
某温度下,化学反应 A =" B" + C中反应物A的浓度在5s内从2.0 mol/L减少到1.0 mol/L。在这段时间内,用A的浓度变化表示的平均反应速率为
| A.0.4 mol•L—1 | B.0.2 mol•L—1 |
| C.0.4 mol•L—1•s—1 | D.0.2 mol•L—1•s—1 |
下列措施不能有效防止钢铁腐蚀的是
| A.在钢铁中加入铬制成不锈钢 |
| B.把钢铁零件放在机油中保存 |
| C.在较小钢铁制品的表面包裹塑料 |
| D.在大型铁壳船表面喷涂油漆并铆上铜块 |
关于化学反应中的说法错误的是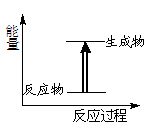
| A.化学键断裂吸收能量,化学键生成放出能量 |
| B.化学反应中有物质变化也有能量变化 |
| C.上图所示的反应为放热反应 |
| D.需要加热的化学反应不一定是吸热反应 |