下列与处理方法对应的反应方程式不正确的是
| A.工业上用水吸收NO2生产硝酸: 3NO2+ H2O = 2HNO3+ NO |
| B.用氨水除去工业原料氯化铵中的氯化铁杂质:Fe3++ 3OH-= Fe(OH)3↓ |
| C.用熟石灰处理泄漏的液氯:2Ca(OH)2+2Cl2= CaCl2+ Ca(ClO)2+2H2O |
D.用明矾除去水中的悬浮颗粒物:Al3++ 3H2O 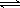 Al(OH)3 (胶体) + 3H+ Al(OH)3 (胶体) + 3H+ |
M(NO3)2热分解化学方程式为:2 M(NO3)2  2MO+4NO2↑+O2↑。加热29.6g M(NO3)2使其完全分解,在标准状况下收集11200mL的气体,那么M的摩尔质量是
2MO+4NO2↑+O2↑。加热29.6g M(NO3)2使其完全分解,在标准状况下收集11200mL的气体,那么M的摩尔质量是
| A.64g/mol | B.24g/mol | C.65g/mol | D.40g/mol |
实验室里利用以下反应制取少量氮气:NaNO2+NH4Cl===NaCl+N2↑+2H2O。关于该反应的下列说法正确的是
| A.NaNO2是氧化剂 |
| B.每生成1 mol N2转移的电子的物质的量为6 mol |
| C.NH4Cl中的氮元素被还原 |
| D.N2既是氧化剂,又是还原剂 |
若溶液中由水电离产生的c(OH-)=1×10-13mol/L,满足此条件的溶液中一定可以大量共存的离子组是
| A.Al3+、Na+、NO、Cl- | B.K+、Na+、Cl-、SO |
| C.K+、Na+、Cl-、CO | D.K+、I-、NO、Cl- |
下列描述正确的是
| A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 |
| B.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 |
| C.可通过溶液导电能力的大小判断强弱电解质 |
| D.在NaHSO4溶液中存在的离子有:Na+、H+、HSO、OH- |
阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是
| A.2.24 L CO2中含有的原子数为0.3×6.02×1023 |
| B.0.1 L 3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3×6.02×1023 |
| C.5.6 g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023 |
| D.4.5 g SiO2晶体中含有的硅氧键数目为0.3×6.02×1023 |