一定条件下反应 2AB(g) A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A.容器中混合气体的质量不随时间变化
B.容器内三种气体 AB、A2、B2共存
C.v正(AB)=2v逆(A2)
D.单位时间内消耗n mol A2,同时生成2n mol AB
下列饮料的包装材料属于无机非金属材料的是()
| A.塑料瓶 | B.纸盒 | C.玻璃瓶 | D.易拉罐 |
下列措施能有效地减少环境污染的是()
| A.废旧电池做填埋处理 | B.焚烧废旧电器回收贵金属 |
| C.随意排放生活污水 | D.减少燃放烟花爆竹 |
普及化学知识有助于人们树立健康的观念。下列观念正确的是()
| A.天然物质都是绿色无毒的物质 | B.只饮用纯净水有益人体健康 |
| C.禁止吸烟可减少室内空气污染 | D.微量元素只能通过保健品摄入 |
等质量的铝粉与足量盐酸在不同条件下反应,产生H2的体积与反应时间关系如下图所示,则图中曲线a、b、c分别对应表中的实验组别是()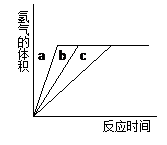
| 实验组别 |
盐酸浓度(mol/L) |
温度(℃) |
| ① |
2.00 |
15 |
| ② |
2.00 |
30 |
| ③ |
4.00 |
30 |
A.①—②—③ B.②—①—③ C.②—③—① D.③—②—①
根据下列实验方法和现象,得出结论正确的是()
A.某溶液 生成白色沉淀,则原溶液中一定含有Cl— 生成白色沉淀,则原溶液中一定含有Cl— |
B.某溶液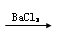 生成白色沉淀,则原溶液中一定含有SO42— 生成白色沉淀,则原溶液中一定含有SO42— |
C.某溶液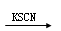 溶液呈红色,则原溶液中一定含有Fe3+ 溶液呈红色,则原溶液中一定含有Fe3+ |
D.某溶液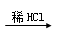 有气体产生,则原溶液中一定含有CO32— 有气体产生,则原溶液中一定含有CO32— |