已知某化学反应的平衡常数表达式为K=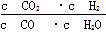 ,在不同的温度下该反应的平衡常数如表所示:下列有关叙述不正确的是
,在不同的温度下该反应的平衡常数如表所示:下列有关叙述不正确的是
| t℃ |
700 |
800 |
830 |
1 000 |
1 200 |
| K |
1.67 |
1.11 |
1.00 |
0.60 |
0.38 |
A.该反应的化学方程式是CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
B.上述反应的正反应是放热反应
C.如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830℃,此时测得CO2为0.4 mol,该反应达到平衡状态
D.某温度下,如果平衡浓度符合下列关系式: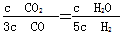 ,判断此时的温度是1 000℃
,判断此时的温度是1 000℃
某物质溶于水,所得溶液既能使蓝色石蕊试液变红,也能与碳酸盐反应生成气体,此物质可能是①氧化物②盐③碱④单质⑤酸中的
| A.①⑤ | B.①②④⑤ | C.② | D.①②③④⑤ |
下列物质中,属于电解质的是
| A.蔗糖 | B.盐酸 | C.氯化钠 | D.二氧化碳 |
120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是
| A.2.0 mol·L-1 | B.1.5 mol·L-1 |
| C.0.18 mol·L-1 | D.0.24 mol·L-1 |
将13.7g Na2CO3和NaHCO3的混合物充分加热,共收集到标准状况下的气体1.12L,则混合物中Na2CO3和NaHCO3的物质的量之比为
| A.1︰1 | B.1︰2 | C.2︰1 | D.3︰1 |
下列溶液中氯离子浓度与50mL 1mol·L-1氯化铝溶液中氯离子浓度相等的是
| A.150mL 1mol·L-1氯化钠溶液 | B.75mL 2mol·L-1的氯化铵溶液 |
| C.150mL 3mol·L-1的氯化钾溶液 | D.75mL 1mol·L-1的氯化亚铁溶液 |