几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 |
X |
Y |
Z |
W |
| 原子半径/pm |
160 |
143 |
70 |
66 |
| 主要化合价 |
+2 |
+3 |
+5、+3、-3 |
-2 |
下列叙述正确的是
A.X、Y元素的金属性X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
从海水中提取溴的常用的一种工艺涉及到以下过程:①氧化,用Cl2将海水中的NaBr氧化成Br2;②将海水浓缩;③提取,用Cl2将HBr氧化成Br2得到产品;④富集,用空气和水蒸气将Br2吹入吸收塔与吸收剂SO2水溶液反应生成HBr,则正确的步骤为()
| A.②①③④ | B.①②③④ | C.③②①④ | D.②①④③ |
下列各组物质,不需要经过化学变化就能够从海水中获得的是()
| A.氯、溴、碘 | B.钠、镁、铝 | C.烧碱、氢气 | D.食盐、淡水 |
如图
甲,把锌片和铜片用导线相连后插入稀硫酸溶液构成原电池。某实验兴趣小组做完实验后,在读书卡上的记录如图乙所示,则卡片上的描述合理的是()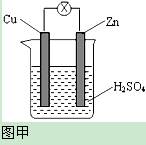

| A.①②③ | B.②④ | C.④⑤⑥ | D.③④⑤ |
对于反应2SO2(g)+O2(g)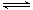 2SO3(g),能增大正反应速率的措施是()
2SO3(g),能增大正反应速率的措施是()
| A.通入大量O2 | B.增大容器容积 |
| C.移去部分SO3 | D.降低体系温度 |
下列说法正确的是( )
①原子序数为15的元素的最高化合价为+3
②ⅦA族元素是同周期中非金属性最强的元素
③第二周期ⅣA族元素的原子质子数和中子数一定为6
④IA族和IIA族的元素全部是金属元素
⑤元素周期表有7个周期、16个纵行
| A.② | B.①③⑤ | C.①②⑤ | D.③④ |