已知:(1)Zn(s)+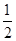 O2(g)===ZnO(s) ΔH=-348.3 kJ·mol-1
O2(g)===ZnO(s) ΔH=-348.3 kJ·mol-1
(2)2Ag(s)+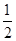 O2(g)===Ag2O(s) ΔH=-31.0 kJ·mol-1
O2(g)===Ag2O(s) ΔH=-31.0 kJ·mol-1
则Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)的ΔH等于
| A.-317.3 kJ·mol-1 | B.-379.3 kJ·mol-1 |
| C.-332.8 kJ·mol-1 | D.317.3 kJ·mol-1 |
为测定人体血液中Ca2+的含量,设计了如下方案:
有关反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4K2SO4+2MnSO4+10CO2↑+8H2O。若血液样品为15mL,滴定生成的草酸消耗了0.001mol·L-1的KMnO4溶液15.0mL,则这种血液样品中的含钙量为
A.0.001mol·L-1B.0.0025mol·L-1C.0.0003mol·L-1D.0.0035mol·L-1
NA代表阿伏加德罗常数,下列说法不正确的是
| A.一定量的Fe与含1mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA |
| B.1 L0.5mol/LNa2CO3溶液中含有的CO32-数目为0.5NA |
| C.标准状况下,2.24L Cl2与足量的Mg充分反应,转移的电子数目为0.2NA |
| D.0.1mol CH4所含的电子数为NA |
某碱性蓄电池在充电和放电时发生的反应为:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2,下列说法中正确的是
Fe(OH)2+Ni(OH)2,下列说法中正确的是
| A.放电时,负极上发生反应的物质是NiO2 |
| B.放电时,正极反应是:NiO2+2e-+2H+=Ni(OH)2 |
| C.充电时,阴极反应是:Ni(OH)2-2e-+2OH-=NiO2+2H2O |
| D.充电时,阳极附近pH值减小 |
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH—=Fe3O4+S4O62-+2H2O,下列说法中,正确的是
| A.Fe2+和S2O32—都是还原剂 |
| B.x=6 |
| C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol |
| D.每生成1mol Fe3O4,反应转移的电子总数为3mol |
某温度下,某容积恒定的密闭容器中发生如下可逆反应:
CO(g)+H2O(g) H2(g)+CO2(g)△H>0。当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可以采用的是
H2(g)+CO2(g)△H>0。当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可以采用的是
| A.升高温度 | B.加入催化剂 |
| C.再加入n molCO和n molH2O | D.再加入2n molCO2和2n molH2 |