对于反应:CaCO3+2HCl=CaCl2+H2O+CO2↑,下列说法正确的是
| A.用HCl和CaCl2表示的反应速率数据不同,但所表示的意义相同 |
| B.不能用CaCO3的浓度变化来表示反应速率,但可用水来表示 |
| C.用H2O和CO2表示的化学反应速率相同 |
| D.用CaCl2浓度的减小表示其反应速率 |
NA表示阿伏加德罗常数,下列说法正确的是
| A.标准状况下11.2L的水中含有0.5个NA水分子 |
| B.含1 mol HCl的盐酸中离子总数为NA个 |
| C.1 mol H2和O2的混合气体中含NA个分子 |
| D.1 mol大米中含有NA个大米粒子 |
如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是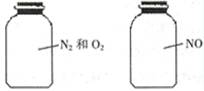
A.所含原 子数相等 子数相等 |
B.气体密度相等 |
| C.气体质量相等 | D.摩尔质量相等 |
下列说法正确的是
| A.摩尔质量就等于物质的式量 | B.摩尔质量就是物质式量的6.02×1023倍 |
| C.HNO3的摩尔质量是63g | D.硫酸和磷酸(H3PO4)的摩尔质量相等 |
“垃圾是放错了位置的资源”,应该分类回收。生活中废弃 的铁锅、铝制的易拉罐、铜导线等可以归为一类加以回收,它们属于
的铁锅、铝制的易拉罐、铜导线等可以归为一类加以回收,它们属于
| A.氧化物 | B.盐 | C.碱 | D.金属或合金 |
现有一瓶物质甲和乙的混合物,已知甲和乙的某些性质如下:
| 物质 |
熔点(℃) |
沸点(℃) |
密度(g·cm-3) |
水中溶解性 |
| 甲 |
--98 |
57.5 |
0.93 |
可溶 |
| 乙 |
--84 |
77 |
0.90 |
可溶 |
据此,将甲和乙相互分离的最佳方法是
A、萃取法 B、过滤法 C、蒸馏法 D、分液法