25℃时,水中存在电离平衡:H2O  H++OH- △H>0。下列叙述正确的是
H++OH- △H>0。下列叙述正确的是
| A.将水加热,KW增大,pH不变 |
| B.向水中加入少量NaHSO4固体,c(H+)增大,KW不变 |
| C.向水中加入少量NaOH固体,平衡逆向移动,c(OH-)降低 |
| D.向水中加入少量NH4Cl固体,平衡正向移动,c(OH-)增大 |
取物质的量浓度相等的NaOH和H2SO4溶液,以体积比4∶1相混合,所得溶液中的c(OH-)为0.01 mol/L,则原溶液的浓度为
| A.0.01 mol/L | B.0.017 mol/L | C.0.025 mol/L | D.0.250 mol/L |
下列现象与胶体的性质无关的是
| A.将盐卤或石膏加入豆浆,制成豆腐 |
| B.向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀 |
| C.一枝钢笔使用两种不同型号的蓝黑墨水,易出现堵塞 |
| D.清晨,人们经常看到的阳光穿过茂密的树木枝叶所产生的美丽景象 |
一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的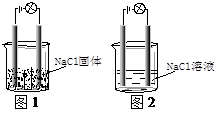
| A.NaCl是非电解质 |
| B.NaCl溶液是电解质 |
| C.NaCl在水溶液中电离出自由移动的离子 |
| D.NaCl在通电时电离出自由移动的离子 |
设NA表示阿伏加德罗常数,下列说法正确的是
| A.1 mol氦气中有2NA个氦原子 |
| B.18 g水中所含的电子数为10NA |
| C.0.3 mol·L-1Na2SO4溶液中含0.6NA个Na+ |
| D.11.2L氮气中含NA个氮原子 |
下列各组物质,按化合物、单质、混合物顺序排列的是
| A.生石灰、白磷、熟石灰 | B.烧碱、液态氧、碘酒 |
| C.干冰、铁、硫酸 | D.盐酸、氮气、胆矾 |