下列说法正确的是
| A.强电解质溶液一定比弱电解质溶液导电能力强 |
| B.BaSO4是弱电解质 |
| C.蔗糖、CO2是非电解质 |
| D.盐酸能导电,所以盐酸是电解质 |
反应2X(g)+Y(g)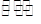 2Z(g)在不同温度下(T1和T2)产物Z的物质的量n(Z)与反应时间t的关系如下图。下列判断正确的是()
2Z(g)在不同温度下(T1和T2)产物Z的物质的量n(Z)与反应时间t的关系如下图。下列判断正确的是()
| A.T1<T2 ,正反应为放热反应 |
| B.T1>T2,正反应为吸热反应 |
| C.T1>T2,逆反应为吸热反应 |
| D.T1<T2,逆反应为放热反应 |
反应C(s) +H2O(g) CO(g) +H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是()
CO(g) +H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是()
| A.增加C的量 |
| B.将容器的体积缩小一半 |
| C.保持体积不变,充入N2使体系压强增大 |
| D.保持压强不变,充入N2使体系体积增大 |
有效碰撞是指()
| A.反应物分子间的碰撞 |
| B.反应物活化分子间的碰撞 |
| C.能发生化学反应的碰撞 |
| D.反应物活化分子间有合适取向的碰撞 |
在下图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹,夹在被Na2SO4溶液浸湿的滤纸条上,滤纸条的中部滴有KMnO4液滴;电源有a、b两极。若在A、B中充满KOH溶液后倒立于盛KOH溶液的水槽中,切断K1,闭合K2.K3,通直流电,实验现象如图所示。下列说法正确的是()
A.电源中a为正极,b为负极
B.试管A中的电极反应式为:2H++2e-=H2↑
C.一段时间后滤纸条上紫红色向C处移动
D.电解一段时间后,切断K2.K3,闭合K1,电流计的指针会发生偏转
下列事实不能用电化学原理解释的是()
| A.轮船水线以下的船壳上装有一定数量的锌块 |
| B.铝片不用特殊方法保护 |
| C.纯锌与稀H2SO4反应时,滴入少量硫酸铜溶液后迅速增大 |
| D.镀锌铁比镀锡铁耐用 |