下列离子组能大量共存的是
| A.H+、K+、OH—、Cl— | B.Na+、Ca2+、CO32—、NO3— |
| C.Cu2+、Na+、OH-、Cl— | D.Ba2+、HCO3—、NO3—、K+ |
燃料电池是燃料(例如CO、H2、CH4等)跟氧气或空气反应,将此反应的化学能转化为电能的装置,电解质通常是KOH溶液,则下列关于甲烷燃料电池的说法正确的是()
| A.负极反应式为:CH4+10OH--8e-=CO32-+7H2O |
| B.正极反应式为:O2+4H++4e-=2H2O |
| C.随着反应地进行,KOH溶液物质的量浓度不变 |
| D.该电池的总反应与甲烷燃烧的反应方程式相同,反应式为:CH4+2O2=CO2+2H2O |
活化分子是衡量化学反应速率快慢的重要依据,下列说法中不正确的是()
| A.增大压强,可使活化分子数增多,反应速率加快 |
| B.增大反应物的浓度,可使单位体积内活化分子数增多,反应速率加快 |
| C.能够发生有效碰撞的分子一定是活化分子 |
| D.升高温度,使单位体积内活化分子百分数大大增加 |
如图甲为锌铜原电池装置,乙为电解熔融氯化钠装置。则下列说法正确的是()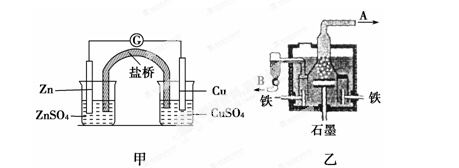
| A.甲装置中锌为负极,发生还原反应 |
| B.甲装置盐桥的作用是使反应过程中ZnSO4溶液和CuSO4溶液保持电中性 |
| C.乙装置中铁极为阳极,电极反应式为: 2Na++2e-=2Na |
| D.乙装置中B是氯气出口,A是钠出口 |
已知反应:
①101 kPa时,2C(s)+O2(g) =2CO(g) ΔH=-221 kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq) =H2O(l) ΔH=-57.3 kJ·mol-1
③在同温同压下,S(g)+O2(g)=SO2(g) ΔH1
下列结论正确的是()
| A.H2SO4和Ba(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol |
| B.C的标准燃烧热为-110.5 kJ·mol-1 |
| C.稀醋酸与稀NaOH溶液反应生成1 mol水放出的热量为57.3 kJ |
| D.由③知S(s)+O2(g)=SO2(g)ΔH2则ΔH2>ΔH1 |
下列关于化学反应速率的说法正确的是( )
| A.根据化学反应速率的大小可以知道化学反应进行的快慢 |
| B.化学反应速率为0.8mol/(L·s)是指1s时某物质的浓度为0.8mol/L |
| C.化学反应速率是指一定时间内反应物的物质的量减少或生成物的物质的量增加 |
| D.对于任何化学反应来说,反应速率越大,反应现象就越明显 |