某同学在实验室发现一瓶由碳酸钠和氯化钠组成的混合溶液.为了测定该混合溶液中碳酸钠的质量分数,该同学设计了如下实验:取该混合溶液50g,向其中逐滴加入稀盐酸,当加入盐酸的质量为15g、30g、45g、60g时,生成气体的质量见下表(气体的溶解度忽略不计).
| |
第Ⅰ组 |
第Ⅱ组 |
第Ⅲ组 |
第Ⅳ组 |
| 稀盐酸的质量/g |
15[] |
30 |
45 |
60 |
| 生成气体的质量/g |
1.8 |
n |
4.4 |
4.4 |
(1)第Ⅱ组数据n为多少
(2)混合溶液中碳酸钠的质量分数是多少?(写出计算过程,结果精确至0.1%)
已知Cl-和Ag+反应生成AgCl,每次新生成的AgCl中又有10%见光分解成单质银和氯气,氯气又可在水溶液中岐化成HClO3(为强酸)和HCl。而这样生成的Cl-又与剩余的Ag+作用生成沉淀,如此循环往复,直至最终。现有含1.1molNaCl的溶液,向其中加入足量AgNO3,求最终能生成多少克难溶物(AgCl和Ag)?若最后溶液体积为1L,求溶液中H+物质的量浓度是多少?
用黄铁矿可以制取 H2SO4,再用 H2SO4可以制取化肥(NH4)2SO4。煅烧含 FeS2 80.2% 的黄铁矿 75.0 t,最终生产出 79.2 t(NH4)2SO4。已知 NH3的利用率为 92.6%,H2SO4的利用率为 89.8%,试求黄铁矿制取 H2SO4时的损失率。
在120℃时,将气体A 3.88 g通过足量的 ,放出
,放出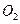 ,充分反应后固体的质量增加2.28 g,试通过计算判断气体 A的组成及各成分的质量。
,充分反应后固体的质量增加2.28 g,试通过计算判断气体 A的组成及各成分的质量。
为了测定某种碱金属的相对原子质量,有人设计了如图所示的实验装置。该装置(包括足量的水)的总质量为 。将质量为
。将质量为 的某碱金属单质放入水中,立即塞紧瓶塞,完全反应后再称量此装置的总质量为
的某碱金属单质放入水中,立即塞紧瓶塞,完全反应后再称量此装置的总质量为 。
。
(1)列出计算该碱金属相对原子质量的数学表达式;
(2)无水氯化钙的作用是什么?如果不用 ,测定的碱金属相对原子质量比实际值偏大还是偏小?说明理由。
,测定的碱金属相对原子质量比实际值偏大还是偏小?说明理由。
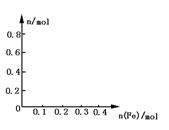
向含有0.8mol的稀硝酸溶液中慢慢加入22.4g的铁粉.假设反应分为两个阶段.第一阶段为:Fe+HNO3 Fe(NO3)3+NO↑+H2O
Fe(NO3)3+NO↑+H2O
(1)写出这两个阶段反应的离子方程式.
(2)求这两个阶段反应中,加入铁粉的物质的量和溶液中铁元素存在的形式.
(3)在图中画出溶液中Fe2+、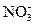 离子的物质的量随加入铁粉的物质的量变化的关系图像(纵坐标是溶液中离子的物质的量).
离子的物质的量随加入铁粉的物质的量变化的关系图像(纵坐标是溶液中离子的物质的量).