氯元素(Cl)是最重要的“成盐元素”,主要以NaCl的形式存在于海水和陆地的盐矿中。食盐不仅是人体必需的物质,而且是重要的化工原料,从海水中提取氯并应用于工农业生产中的图示如下。

(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质、精制后可得饱和NaCl溶液。精制时通常在溶液中依次加入的试剂及操作正确的是 ;
A.过量的BaCl2 过量NaOH
过量NaOH 过量Na2CO3
过量Na2CO3 过滤
过滤 过量HCl
过量HCl
B.过量的NaOH 过量Na2CO3
过量Na2CO3 过量BaCl2
过量BaCl2 过滤
过滤 过量HCl
过量HCl
C.过量的BaCl2 过量Na2CO3
过量Na2CO3 过量NaOH
过量NaOH 过滤
过滤 过量HCl
过量HCl
D.过量的NaOH 过量 BaCl2
过量 BaCl2 过量Na2CO3
过量Na2CO3  过量HCl
过量HCl 过滤
过滤
写出加入盐酸后可能发生的化学反应的离子方程式 。
(2)工业上用电解饱和食盐水的方法制取烧碱和氢气、氯气。下图是电解饱和食盐水装置的一部分,请将装置补充完整,并标出阴阳极和通电时溶液中离子移动的方向。

阴极反应式为 ;反应类型 (填氧化或还原反应),
总电极反应式为 。
(3)在实验室中用浓盐酸与MnO2共热可制取Cl2。
①下列收集Cl2的装置正确的是_______________ ;

②检验是否有氯气生成可采用的方法是 ;
A.用干燥的蓝色石蕊试纸 B.用干燥的有色布条
C.用湿润的淀粉碘化钾试纸 D.将气体通入硝酸银溶液
③将制得的Cl2与Ca(OH)2充分反应,可制得漂粉精,写出反应的化学方程式 。
紫杉醇是一种新型抗癌药,其分子式为C47H51NO14,它是由如下的A酸和B醇生成的一种酯。
A. 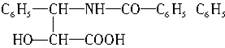 —是苯基
—是苯基
B.R—OH(R是一个含有C、H、O的基团)
(1)A可在无机酸催化下水解,其反应的方程式是___________________________。
(2)A水解所得的氨基酸,不是天然蛋白质水解产物,因为氨基不在____(填希腊字母)位。
(3)写出ROH的分子式_________________________。
科学家发现某药物M能治疗心血管疾病是因为它在人体内能释放出一种“信使分子”D,并阐明了D在人体内的作用原理。为此他们荣获了1998年诺贝尔生理学和医学奖。
请完成下列问题:
(1)已知M的相对分子质量为227,由C、H、O、N 4种元素组成,C、H、N的质量分数依次为15.86%、2.20%和18.50%。则M的分子式是________。D是双原子分子,相对分子质量为30,则D的分子式为________。
(2)油脂A经下列途径可得到M。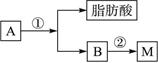
图中②的提示: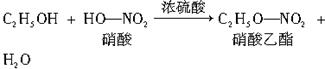
反应①的化学方程式是______________________________________________________。
反应②的化学方程式是______________________________________________________。
(3)C是B和乙酸在一定条件下反应生成的化合物,相对分子质量为134,写出C所有可能的结构简式:______________________________________________。
(4)若将0.1 mol B与足量的金属钠反应,则需消耗________g金属钠。
某天然油脂A的分子式为C57H106O6,1 mol该油脂水解可得到1 mol甘油、1 mol不饱和脂肪酸B和2 mol直链饱和脂肪酸C。经测定B的相对分子质量为280,原子个数比为C∶H∶O=9∶16∶1。
(1)写出B的分子式:_____________________________。
(2)写出C的结构简式:___________________________。
C的名称:________________________。
(3)写出含有5个碳原子的C同系物的同分异构体的结构简式:___________________。
已知两个羧基之间在浓硫酸作用下脱去一分子水生成酸酐,如: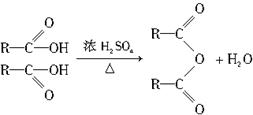
某酯类化合物A是广泛使用的塑料增塑剂。A在酸性条件下能够生成B、C、D。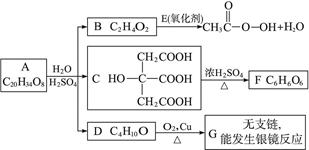
(1)CH3COOOH称为过氧乙酸,写出它的一种用途_______________。
(2)写出B+E→CH3COOOH+H2O的化学方程式____________________。
(3)写出F可能的结构简式____________________。
(4)写出A的结构简式________________________。
(5)1 mol C分别和足量的金属Na\,NaOH反应,消耗Na与NaOH物质的量之比是_______。
(6)写出D跟氢溴酸(用溴化钠和浓硫酸的混合物)加热反应的化学方程式:____________________________________。
有机物A为茉莉香型香料。
(1)A分子中含氧官能团的名称是___________。
(2)C的分子结构可表示为(其中R·和R′·代表不同的烃基):
A的化学式是________,A可以发生的反应是________ (填写序号字母)。
a.还原反应 b.消去反应 c.酯化反应 d.水解反应
(3)已知含有烃基R的有机物R—OH与浓溴水反应产生白色沉淀,则含有烃基R′的有机物R′—OH的类型属于________。
(4)A分子结构中只有一个甲基,A的结构简式是________________。
(5)在浓硫酸存在下,B与乙醇共热生成化合物C10H22O2的化学方程式是_______________________________________________。
(6)在A的多种同分异构体中,分子结构中除烃基R′含有三个甲基外,其余部分均与A相同的有________种。