下列对选修四教材中的数据叙述正确的是( )
| A.单独利用焓变的数据或熵变的数据就能判断化学反应能否自发进行 |
| B.利用一元弱酸的电离平衡常数相对大小可以判断其相应可溶性盐的水解程度的相对大小 |
| C.利用反应热数据的大小可以判断不同反应的反应速率的大小 |
| D.利用溶液的pH与7的大小关系,可以判断任何温度下溶液的酸碱性 |
下列溶液中各微粒的浓度关系正确的是
A.等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=c(Ba2+)
B.将10 mL 0.1 mol·L-1 Na2CO3溶液逐滴滴加到10 mL 0.1 mol·L-1盐酸中:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)
C.向NH4HCO3溶液中滴加NaOH溶液至pH=7:c(NH4+)+c(Na+)= c(HCO3-)+c(CO32-)
D.0.2 mol·L-1的某一元弱酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后的溶液:2c(OH一)+c(A一)=2c(H+)+c(HA)
实验室一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样(如图所示)。已知,固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种。若取少量固体M配成稀溶液进行有关实验,下列说法不正确的是
| A.只用盐酸一种试剂就可以确定该固体M的具体成分 |
| B.往溶液中通入二氧化碳,若有白色沉淀,则固体M为Na2SiO3 |
| C.往溶液中加入稀硝酸酸化的BaCl2,若有白色沉淀,则固体M为Na2SO4 |
| D.用pH试纸检验,若常温下pH=7,则固体M一定是Na2SO4 |
短周期元素X、Y、Z、W、Q在元素周期表中的位置如下表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是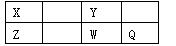
| A.W得电子能力比Q强 |
| B.由Z与Y组成的物质在熔融时能导电 |
| C.钠与Y可能形成Na2Y 2化合物且该化合物离子键和共价键 |
| D.X有多种同素异形体,而Y不存在同素异形体 |
在学习中,我们经常应用类推法。下列左边正确,类推法应用于右边也正确的是
| AA |
向FeCl2溶液中滴入氯水 2Fe2++ Cl2= 2Fe3++ 2Cl— |
向FeCl2溶液中滴入碘水 2Fe2++ I2= 2Fe3++2I— |
| B |
CO2通入漂白粉溶液中 CO2+ Ca2++2ClO—+H2O=CaCO3↓+ 2HClO |
SO2通入漂白粉溶液中 SO2 +Ca2++2ClO—+H2O=CaSO3↓+2HClO |
| C |
向Na2CO3溶液中滴入稀HNO3 CO32—+ 2H+ = CO2↑+ H2O |
向Na2SO3溶液中滴入稀HNO3 SO32— +2H+ = SO2↑+H2O |
| D |
向澄清石灰水中通入少量CO2气体 Ca2++2OH— +CO2= CaCO3↓+ H2O |
向澄清石灰水中通入少量SO2气体 Ca2++2OH— +SO2= CaSO3↓+H2O |
下列判断错误的是
| A.酸性:HClO4>H2SO4>H3PO4 | B.沸点:NH3>PH3>AsH3 |
| C.熔点:Si3N4>NaCl>SiI4 | D.碱性:NaOH>Mg(OH)2>Al(OH)3 |