下列各表述与示意图一致的是( )
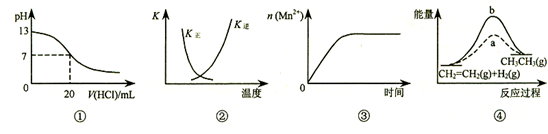
A.图②中曲线表示反应2SO2(g) + O2(g)  2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化 |
| B.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
| C.图③表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 |
D.图④中a、b曲线分别表示反应CH2=CH2 (g) + H2(g) CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化 CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化 |
滴有酚酞和氯化钠试液滤纸分别做甲、乙两个实验,能发现附近变成红色的电极是
| A.ac | B.bd | C.ad | D.bc |
可逆反应N2+3H2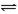 2NH3是一个放热反应。甲、乙是完全相同的容器,甲容器中加入1molN2和3 molH2,一定条件下,达平衡时放出的热量为Q1;在相同条件下,向乙容器加入2 molNH3,达平衡时,吸收的热量为Q2。已知Q2=4Q1,则甲容器中,H2的转化率
2NH3是一个放热反应。甲、乙是完全相同的容器,甲容器中加入1molN2和3 molH2,一定条件下,达平衡时放出的热量为Q1;在相同条件下,向乙容器加入2 molNH3,达平衡时,吸收的热量为Q2。已知Q2=4Q1,则甲容器中,H2的转化率
| A.20% | B.25% | C.75% | D.80% |
等体积,等物质的量浓度①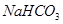 、②
、②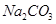 两种溶液的叙述不正确的是
两种溶液的叙述不正确的是
A.溶液中C(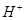 ) ②<① ) ②<① |
| B.溶液中阴离子的物质的量浓度之和:②>① |
C.②溶液中: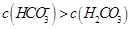 |
D.①溶液中: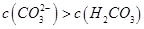 |
有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是
| A.V3>V2>V1 | B.V3=V2=V1 |
| C.V3>V2=V1 | D.V1=V2>V3 |
在一定温度下,一定体积的密闭容器中有如下平衡: H2(气)+I2(气)  2HI(气)
2HI(气)
已知H2和I2的起始浓度均为0.1mol·L-1时,达平衡时HI的浓度为0.16mol·L-1。
若H2和I2的起始浓度均变为0.2mol·L-1,平衡时H2的浓度(mol·L-1)是
| A.0.16 | B.0.08 | C.0.04 | D.0.02 |