下列有关热化学方程式的叙述正确的是( )
| A.I2(g)+ H2(g)="2HI(g)" △H1;I2(s)+ H2(g)="2HI(g)" △H2,则△H1>△H2 |
| B.2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ·mol-1,则氢气燃烧热为285.8kJ·mol-1 |
| C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+CH3COOH(aq)=CH3COONa(aq) + H2O(l) △H =-57.3kJ·mol-1 |
D.已知2SO2(g)+O2(g)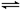 2SO3 (g);△H=-QkJ·mol-1(Q>0),则将16gSO2(g)和足量O2置于一密闭容器中,充分反应后放出0.25QkJ的热量 2SO3 (g);△H=-QkJ·mol-1(Q>0),则将16gSO2(g)和足量O2置于一密闭容器中,充分反应后放出0.25QkJ的热量 |
利用右图所示装置进行下列实验,能得出相应实验结论的是
| 选项 |
① |
② |
③ |
实验结论 |
 |
| A |
浓盐酸] |
MnO2 |
NaOH[来Com] |
制氯气并吸收尾气[来 |
|
| B |
浓硫酸 |
蔗糖 |
溴水 |
浓硫酸具有脱水性、氧化性 |
|
| C |
稀盐酸 |
Na2SO3 |
Ba(NO3)2溶液 |
SO2与可溶性钡盐均可生成白色沉淀 |
|
| D |
浓硝酸 |
Na2CO3 |
Na2SiO3溶液 |
酸性:硝酸>碳酸>硅酸 |
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是
| A.Y的气态简单氢化物的热稳定性比W的强 |
| B.X的最高价氧化物对应水化物的酸性比W的弱 |
| C.Y分别与Z、W形成的化合物均为碱性氧化物 |
| D.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) |
茶叶中铁元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品正确且完整是
| A.将茶叶灼烧灰化,选用①、② |
| B.用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ |
| C.过滤得到的滤液,选用④、⑤ |
| D.检验滤液中的Fe3+,选用③、⑧、⑩ |
下列离子方程式不正确的是
| A.Fe3O4与稀硝酸反应的离子方程式为:Fe3O4 + 8H+===Fe2++2Fe3++4H2O |
| B.用稀硫酸除去铜绿:4H++Cu2(OH)2CO3==2Cu2++CO2↑+3H2O |
| C.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42—完全沉淀:2Ba2++NH4++Al3++2SO42-+4OH-== Al(OH)3↓+NH3·H2O+2BaSO4↓ |
| D.少量氢氧化钙溶液与碳酸氢钠溶液混合:Ca2++2OH-+2HCO3—==CaCO3↓+2H2O+CO32— |
设NA代表阿伏加德罗常数的数值,下列说法正确的是
| A.10 mL 20 mol·L-1浓硫酸与足量锌反应,转移电子数为0.2NA |
| B.0.1 mol 24Mg18O晶体中所含中子总数为2.0 NA |
| C.在标准状况下,2.8g N2和2.24L CO所含电子数均为1.4NA |
| D.1 L 1 mol·L-1的NaClO溶液中含有ClO-的数目为NA |