氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气的燃烧热值高,H2(g) +1/2 O2 (g) = H2O (g) ΔH = -241.8 kJ·mol-1
| 化学键 |
H-H |
O=O |
O-H |
| 键能(kJ·mol-1) |
X |
496.4 |
463 |
请根据相关数据计算:H-H的键能X = ________kJ·mol-1。
(2)根据现代工业技术可以用H2和CO反应来生产燃料甲醇,其反应方程式如下:
CO2 (g) +3H2(g) H2O(l) + CH3OH(g) ΔH = -49.00 kJ·mol-1
H2O(l) + CH3OH(g) ΔH = -49.00 kJ·mol-1
一定温度下,在体积为1 L的密闭容器中充入1.00 mol CO2和3.00 mol H2,测得CO2和CH3OH的浓度随时间变化如图所示。
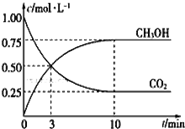
①能说明该反应已达平衡状态的是________(填代号)。
A.CO2在混合气体中的体积分数保持不变
B.单位时间内每消耗1.2 mol H2,同时生成0.4 mol H2O
C.反应中H2O与CH3OH的物质的量浓度比为1:1,且保持不变
②从反应开始到平衡时的平均反应速率v(H2) = ________ ,达到平衡时氢气的转化率为________ 。
③该温度下的平衡常数表达式为________ 。
④下列的条件一定能加快反应速率并且提高H2转化率的是________(填代号)。
A.降低反应温度 B.分离出水
C.保持容器体积不变,充入稀有气体 D.保持容器体积不变,充入CO2气体
下图是部分短周期元素 的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单
的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单 质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应。
质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应。
请回答下列问题:
(1)写出物质F的名称,物质E的电子式。
(2)写出下列物质之间反应的化学方程式:
①F和CO2,
②D和E,它(填“是”或“不是” )可逆反应。
(3)G的水溶液呈(填“酸”、“碱”或者“中” )性,写出它与I反应的离子方程式。
化学反应的限度是当___和__相等,反应物和生成物的__保持不变时,所达到的一种看似的“平衡状态”。
用电子式表示:
CaCl2的形成过程______NaOH的电子式___ Cl2 的电子 式___
式___
下列反应中,属于放热反应的是。
① 煅烧石灰石(主要成分是CaCO3)制生石灰(CaO) ② 燃烧木炭取暖③生石灰与水反应 ④ 酸与碱的中和反应⑤ 氢气还原氧化铜 ⑥ 炽热的铁粉与水蒸气的反应
原电池是把转化成___的装置,其反应的实质是_。
写出铜锌原电池(稀硫酸为介质)的电极反应:
正极,负极。