某混合溶液中所含离子为NO3﹣、SO42﹣、H+ 、M浓度分别为 2 mol•L﹣1、1 mol•L﹣1、2 mol•L﹣1、 1 mol•L﹣1,则M离子可能为( )
| A.Mg2+ | B.Ba2+ | C.Na+ | D.S2﹣ |
用下列实验装置进行相应实验,能达到实验目的的是
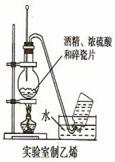
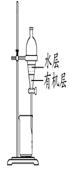
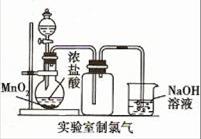
图1图2图3图4
| A.用图1所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
| B.用图2所示装置制取少量乙烯气体 |
| C.用图3所示装置分离CCl4萃取溴水后已分层的有机层和水层 |
| D.用图4所示装置制取少量Cl2气体 |
下列有关物质的性质或应用不正确的是
| A.一定条件下,镁和铁的单质与水反应都有氢气生成 |
| B.浓硫酸能干燥SO2、NO2等气体,说明浓硫酸具有吸水性 |
| C.SO2具有漂白性,通入紫色石蕊溶液中能使溶液先变红后褪色 |
| D.可用FeCl3溶液除去试管内壁上的难以刷去的铜迹 |
下列有关工业生产的叙述正确的是
| A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量 |
| C.电解精炼铜时,阳极溶解铜的质量比阴极析出铜的质量小 |
| D.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.使甲基橙变红的溶液中:Cr2O72- 、Fe2+、SO42-、K+ |
| B.0. 1mol·L-1NaHCO3溶液: Na+、Ba2+、NO3- 、Cl- |
| C.0. 1mol·L-1FeCl3溶液: K+、NH4+、I-、SCN- |
| D.c(H+)/c(OH-)= 1×1014的溶液: Ca2+、Na+、ClO-、NO3- |
下列有关化学用语表示正确的是
| A.乙醛的结构简式: C2H4O | B.F原子的结构示意图:  |
C.中子数为20的氯原子: 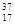 Cl Cl |
D.NH3的电子式: 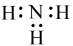 |