有下列三个反应:①Cl2+FeI2═FeCl2+I2 ②2Fe2++Br2═2Fe3++2Br-③Co2O3+6HCl═2CoCl2+Cl2↑+3H2O。下列说法正确的是
| A.①②③中的氧化产物分别是 I2、Fe3+、CoCl2 |
| B.根据以上方程式可以得到氧化性 Cl2>Fe3+>Co2O3 |
| C.可以推理得到 Cl2+FeBr2═FeCl2+Br2 |
| D.在反应③中当1 mol Co2O3参加反应时,2 mol HCl被氧化 |
能说明醋酸是弱电解质的事实是
| A.醋酸溶液的导电性比盐酸弱 |
| B.醋酸溶液与碳酸钙反应,缓慢放出二氧化碳 |
| C.醋酸溶液用水稀释后,氢离子浓度下降 |
| D.0.1mol/L的CH3COOH溶液中,氢离子的浓度约为0.001mol/L |
下列说法正确的是
| A.体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量),后者用时少 |
B.0.1 mol·L-1的醋酸溶液加水稀释, 减小 减小 |
| C.向水中加入少量固体硫酸氢钠,c(H+)增大,KW变大 |
| D.常温下,V1 L pH=11的NaOH溶液与V2 L pH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
高铁电池是一种可逆电池,该电池能长时间保持稳定的放电电压。高铁电池总反应为3Zn+2K2FeO4+8H20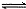 3Zn(OH)2+2Fe(OH)3+4KOH。下列判断不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH。下列判断不正确的是
| A.放电时,负极反应为Zn-2e-+2OH一=Zn(OH)2 |
| B.充电时,阴极pH增大 |
| C.放电时,若有6mol电子转移,则正极有10 mol OH一移向负极 |
| D.充电时,阳极反应为Fe(OH)3+5OH一+3e一=FeO42-+4H2O |
水的电离常数如图两条曲线所示,曲线中的点都符合c(OH一)×c(H+)=常数,下列说法错误的是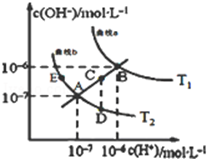
| A.图中温度T1>T2 |
| B.图中五点Kw间的关系:B>C>A=D=E |
| C.曲线a、b均代表纯水的电离情况 |
| D.若处在B点时,将pH=2的硫酸溶液与pH=12的KOH溶液等体积混合后,溶液显碱性 |
Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法不正确的是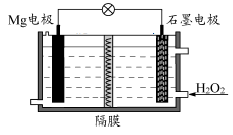
| A.Mg电极是该电池的负极 |
| B.H2O2在石墨电极上发生H2O2+2e-═2OH- |
| C.若隔膜为阳离子交换膜,则正极区有白色沉淀 |
| D.溶液中Cl-向正极移动 |