(1)请把符合要求的化学方程式的编号填在下列空白处:
①既属于分解反应又是氧化还原反应的是________。
②属于化合反应,但不是氧化还原反应的是________。
③既属于化合反应,又是氧化还原反应的是________。
④属于分解反应,但不是氧化还原反应的是________。
⑤不属于四种基本反应类型的氧化还原反应的是________。
| A.2NaHCO3Na2CO3+H2O+CO2↑ |
| B.2Na+Cl22NaCl |
| C.Zn+CuSO4===ZnSO4+Cu |
| D.2KMnO4K2MnO4+MnO2+O2↑ |
E.CaO+CO2CaCO3
F.4FeS2+11O22Fe2O3+8SO2
(2)根据反应Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
①还原剂是________,还原产物是________。
②氧化剂的与氧化产物的物质的量比是________。
③当有9.6g铜参与反应时,在标准状况下,产生气体的体积为________L。
如图所示为短周期的一部分,如果B原子和C原子的核外电子总数之和为A的4倍,则B为(填元素符号)____________,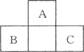
画出A的离子结构示意图: ______________,
C的最高价氧化物的分子式:__________________
用电子式表示A的氢化物分子的形成过程:
A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图为: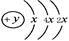 ,B、C可形成离子化合物B3C2,据此填空:
,B、C可形成离子化合物B3C2,据此填空:
(1)A的元素名称为,其气态氢化物的化学式为。
(2)A、B、C、D四种元素的原子,半径由小到大的顺序为。
(3)B和C最高价氧化物的水化物化学式分别为和。
有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C在空气中燃烧时呈现黄色火焰, C的单质在高温下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1)D元素位于周期表中周期族。
(2)写出C2B的水化物与Al(OH)3反应的离子反应方程式 。
(3)画出B的原子结构简图 ___________________。
(4)电子式表示化合物 C2D 的形成过程: 。
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
(1)表中最活泼的金属与最活泼的非金属形成的化学式是_______,含有(填离子键、共价键)
(2)⑦号元素的原子结构示意图为___________,其单质既能与酸反应,又能与碱反应,写出与碱反应的化学方程式。_________________________________________。
(3)②、③、⑨的最高价含氧酸的酸性由强到弱的顺序是(写化学式),
④、⑤、⑧氢化物稳定性由强到弱的顺序是(写化学式)。
(4)①、④、⑥三种元素形成的化合物中化学键的类型:。其化合物类型为
。(填共价化合物、离子化合物)
(5)②和④形成的化合物与④和⑥形成的化合物之间发生氧化还原反应,写出该反应的
化学方程式:。
向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
1)写出并配平CCl4层由紫色变成无色的化学反应方程式。
2)整个过程中的还原剂是。
3)把KI换成KBr,则CCl4层变为__色:继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是。
4)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若庄Kl与Cl2反应制KIO3,至少需要消耗Cl2 L(标准状况,保留2位小数)。