KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。反应的化学方程式为:2KClO3+4HCl(浓)===2KCl+2ClO2↑+Cl2↑+2H2O。
(1)将上述反应改写成离子方程式并分析电子转移的情况(双线桥法表示);
(2)浓盐酸在反应中显示出来的性质是__________(填写编号)。
①还原性; ②氧化性和还原性; ③氧化性; ④酸性
(3)已知浓盐酸的密度为1.18g/cm3,质量分数为36.5%,则该盐酸的物质的量浓度是 。
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂(还原产物是Cl-),其消毒的效率(以单位质量得到的电子数表示)是Cl2的__________倍。
短周期元素ABCD原子序数依次增大。A元素原子核内无中子;B元素原子核外最外层电子数是次外层电子数的2倍;C元素是地壳含量最多的元素;D在短周期元素中金属性最强。请回答:
(1)B在元素周期表中的位置是。
(2)A与C可形成10电子分子,其化合物类型为(填“离子”或“共价”)化合物。
(3)A与C还可以形成一种18电子分子,向其溶液中加入少量二氧化锰粉末,反应的化学方程式为。
(4)D与C按原子个数比为1:1组成的化合物与BC 反应的化学方程式为
反应的化学方程式为
。
下表为元素周期表的一部分,针对表中的①~⑨九种元素,请回答有关问题: (1)⑨的元素符号是__________
(1)⑨的元素符号是__________
(2)在这些元素中,化学性质最不活泼的原子结构示意图为
(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是(填化学式,下同),碱性最强的是,显两性的是。
(4)将元素①与氢元素组成的最简单有机物和⑥的单质按1:1混合后的气体在光照条件下放置一段时间,最多能得到产物。
(5)用电子式表示④和⑥两元素形成化合物的过程为。
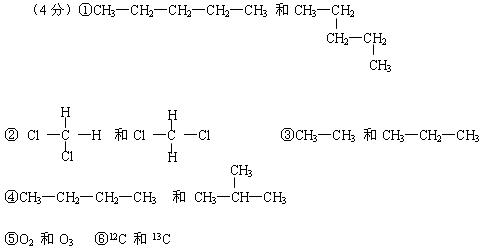
(1)组两原子互为同位素;(2)组是同一物质;
(3)组两物质互称为同系物;(4)组两物质互为同分异构体。
(6分)某温度时,在2L密闭容器中,X、Y、Z 三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析:
(1)该反应的化学方程式:;
(2)反应开始至2min末,X的反应速率为(mol·L-1·min-1);
(3)3min后图中曲线所表示的含义是。
填空回答:
(1)氮化硅是一种高温陶瓷材料。根据元素周期律知识,写出氮化硅的化学式:。
(2)有A、B、C、D、E、F六种元素,它们均属短周期元素,其原子序数依次增大,它们两两形成的化合物有以下几种:
| 形成的化合物 |
甲 |
乙 |
丙 |
丁 |
戊 |
| 化合物中各元素的原子个数比 |
A:C=1:1 |
B:A=1:3 |
D:C=1:1 |
E:F=1:3 |
A:F=1:1 |
已知A、B两元素的核电荷数之差等于其原子最外层电子数之和;B原子最外层电子数比次外层电子数多3个;C原子的最外层电子数是次外层电子数的3倍;D、E、F同周期,D、A同主族;E与F的原子序数之和为30,丙是离子化合物。回答:
① F元素位于周期表中的位置。
② E元素的原子结构示意图为,乙的电子式为,丙的电子式为,B的最高价氧化物的水化物的化学式为。
③向甲的水溶液中加入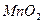 ,反应的化学方程式为。
,反应的化学方程式为。