可逆反应aA(s)+bB(g) cC(g)+dD(g)进行过程中,当其他条件不变时,C的体积分数C%与温度(T)、压强(p)的关系如下图所示。下列叙述正确的是
cC(g)+dD(g)进行过程中,当其他条件不变时,C的体积分数C%与温度(T)、压强(p)的关系如下图所示。下列叙述正确的是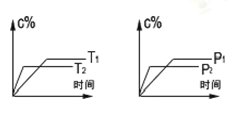
| A.达到平衡后,加入催化剂,C的体积分数增大 |
| B.达到平衡后,升高温度,平衡向左移动 |
| C.化学方程式中,b>c+d[ |
| D.达到平衡后,增加A的量,平衡向右移动 |
电镀废液中Cr2O72-可通过下列反应转化成铬黄(PbCrO4):Cr2O72-(aq)+2Pb2+(aq)+H2O(l)2PbCrO4(s)+2H+(aq) ΔH<0该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是( )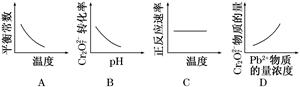
下列热化学方程式或说法,正确的是( )
| A.甲烷的燃烧热为 890 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g);ΔH=-890 kJ·mol-1 |
B.500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g);ΔH=-38.6 kJ·mol-1 2NH3(g);ΔH=-38.6 kJ·mol-1 |
| C.已知:H2(g)+F2(g)=2HF(g);ΔH=-270 kJ·mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ |
| D.在C中相同条件下,2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和 |
反应4A(s)+3B(g)=2C(g)+D(g),经过2 min,B的浓度减少0.6 mol/L,对此反应速率的表示正确的是( )
A.用A表示的反应速率为0.4 mol/(L·min)
B.分别用B、C、D表示的反应速率的比值为3∶2∶1
C.在2 min末的反应速率,用B表示是:0.3 mol/(L·min)
D.在这2 min内用D表示的化学反应速率为:0.1 mol/(L·min)
一定温度下,反应A2(g)+B2(g)2AB(g)达到平衡的标志是( )
| A.单位时间内生成n mol A2的同时生成n mol AB |
| B.容器内的总压强不随时间的变化而变化 |
| C.单位时间内生成2n mol AB的同时生成n mol B2 |
| D.单位时间内生成n mol A2的同时生成n mol B2 |
氢气是人类最理想的能源。已知在25℃、101 kPa下,1 g 氢气完全燃烧生成液态水时放出热量142.9 kJ,则下列热化学方程式书写正确的是( )
| A.2H2+O2=2H2OΔH=-142.9 kJ·mol-1 |
| B.2H2(g)+O2(g)=2H2O(l)ΔH=-142.9 kJ·mol-1 |
| C.2H2(g)+O2(g)=2H2O(l)ΔH=-571.6 kJ·mol-1 |
| D.2H2(g)+O2(g)=2H2O(l)ΔH=+571.6 kJ·mol-1 |